Διαφορά μεταξύ ισοτόπου και ραδιοϊσοτόπου
Κύρια διαφορά – Ισότοπο έναντι Ραδιοϊσότοπου
Τα ισότοπα είναι διαφορετικές μορφές των ατόμων του ίδιου στοιχείου. Τα ραδιοϊσότοπα είναι επίσης ένας τύπος ισοτόπων. Αλλά αυτά τα ισότοπα είναι διαφορετικά αφού είναι ραδιενεργά. Αυτό σημαίνει ότι αυτά τα ισότοπα μπορούν να υποστούν ραδιενεργό διάσπαση. Τα άτομα υφίστανται ραδιενεργό διάσπαση όταν τα άτομα τους είναι ασταθή. Επομένως, τα ασταθή ισότοπα ενός συγκεκριμένου χημικού στοιχείου είναι τα ραδιοϊσότοπα αυτού του στοιχείου. Η βασική διαφορά μεταξύ των ισοτόπων και των ραδιοϊσοτόπων είναι ότι ταισότοπα μπορεί να υποστούν ή να μην υποστούν ραδιενεργό διάσπαση ενώ τα ραδιοϊσότοπα ουσιαστικά υφίστανται ραδιενεργό διάσπαση.
Βασικές περιοχές που καλύπτονται
1. Τι είναι Ισότοπο
– Ορισμός, Ιδιότητες, Παραδείγματα
2. Τι είναι το Ραδιοϊσότοπο
– Ορισμός, Ιδιότητες, Παραδείγματα
3. Ποια είναι η διαφορά μεταξύ ισοτόπου και ραδιοϊσοτόπου
– Σύγκριση βασικών διαφορών
Βασικοί όροι:Χρόνος ημιζωής, ισότοπα, ραδιενεργός διάσπαση, ραδιενέργεια, ραδιοϊσότοπα

Τι είναι ισότοπο
Τα ισότοπα είναι διαφορετικές μορφές ατόμων του ίδιου στοιχείου. Αποτελούνται από τον ίδιο αριθμό πρωτονίων στον πυρήνα τους και έχουν τον ίδιο ατομικό αριθμό. Αυτό συμβαίνει επειδή τα άτομα του ίδιου στοιχείου έχουν τον ίδιο ατομικό αριθμό. Αλλά ο αριθμός των νετρονίων που υπάρχουν στους πυρήνες τους είναι διαφορετικός μεταξύ τους. Επομένως, οι ατομικές μάζες των ισοτόπων είναι διαφορετικές μεταξύ τους.
Μερικά ισότοπα ορισμένων χημικών στοιχείων είναι σταθερά όταν άλλα ισότοπα είναι ασταθή. Σταθερά ισότοπα μπορούν να εμφανιστούν είτε μόνα τους είτε σε συνδυασμό με άλλα στοιχεία στη φύση. Αλλά ασταθή ισότοπα δεν μπορούν να εμφανιστούν στη φύση. Προκειμένου να γίνουν σταθερά, αυτά τα ασταθή ισότοπα υφίστανται ραδιενεργό διάσπαση.
Ωστόσο, η χημική συμπεριφορά των ισοτόπων ενός συγκεκριμένου χημικού στοιχείου είναι η ίδια επειδή όλα τα ισότοπα έχουν τον ίδιο αριθμό ηλεκτρονίων και την ίδια ατομική δομή σε σχέση με την ηλεκτρονική διαμόρφωση. Έχουν όμως διαφορετικές φυσικές ιδιότητες λόγω των διαφορών στις ατομικές τους μάζες. Αυτές οι διαφορές μπορούν να παρατηρηθούν κυρίως σε μικρότερα χημικά στοιχεία όπως το υδρογόνο.
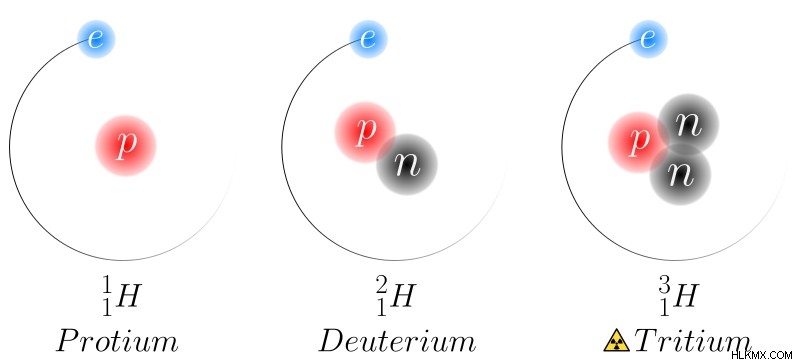
Εικόνα 1:Ισότοπα υδρογόνου
Για παράδειγμα, όταν λαμβάνονται υπόψη τα ισότοπα του υδρογόνου, υπάρχουν τρία κύρια ισότοπα του στοιχείου υδρογόνου. Είναι το πρωτίου, το δευτέριο και το τρίτιο. Όλα αυτά τα ισότοπα έχουν τον ίδιο αριθμό πρωτονίων στον πυρήνα τους, ένα πρωτόνιο. Το Protium δεν έχει νετρόνια. Το δευτέριο έχει ένα νετρόνιο και το τρίτιο έχει δύο νετρόνια. Επομένως, στα ισότοπα υδρογόνου, οι ατομικές μάζες έχουν μεγάλες διαφορές μεταξύ τους. Όμως, όλα αυτά τα ισότοπα έχουν μόνο ένα ηλεκτρόνιο. Επομένως, οι χημικές ιδιότητες των ισοτόπων υδρογόνου είναι σχεδόν οι ίδιες.
Τι είναι το Ραδιοϊσότοπο
Το ραδιοϊσότοπο είναι ένα ασταθές ισότοπο ενός χημικού στοιχείου που μπορεί να υποστεί ραδιενεργό διάσπαση. Δεδομένου ότι αυτά τα ισότοπα είναι ασταθή, υφίστανται ραδιενεργό διάσπαση για να γίνουν σταθερά. Τα περισσότερα σταθερά ισότοπα δεν εμφανίζουν ραδιενέργεια.
Ο όρος "ημιζωή " ορίζεται ως ο χρόνος που χρειάζεται μια ένωση για να πάρει το ήμισυ της αρχικής της μάζας μέσω της ραδιενεργής διάσπασης. Για ασταθή ραδιοϊσότοπα, ο χρόνος ημιζωής είναι πολύ σύντομος. Γρήγορα υφίστανται ραδιενέργεια και γίνονται σταθερά.
Η ραδιενεργή διάσπαση προκαλεί εκπομπή ακτινοβολίας. Τα ασταθή ισότοπα έχουν μεγάλο αριθμό νετρονίων ή πρωτονίων στους πυρήνες τους. Τα πλούσια σε νετρόνια ισότοπα μπορούν να εκπέμπουν ακτινοβολία μετατρέποντας τα νετρόνια σε διαφορετικά σωματίδια. Στα πλούσια σε πρωτόνια ισότοπα, τα πρωτόνια μετατρέπονται σε διαφορετικά σωματίδια. Αυτά τα σωματίδια εκπέμπονται ως ακτινοβολία. Υπάρχουν τρεις κύριοι τύποι ακτινοβολίας που μπορεί να εκπέμψει ένα ραδιοϊσότοπο. Είναι η ακτινοβολία άλφα, η ακτινοβολία βήτα και η ακτινοβολία γάμμα. Αυτές οι ακτινοβολίες μπορούν να βλάψουν το σώμα μας διεισδύοντας στο δέρμα. Επομένως, θα πρέπει να προσέχουμε όταν χειριζόμαστε αυτά τα στοιχεία.

Εικόνα 2:Τα ραδιοϊσότοπα φυλάσσονται σε χρηματοκιβώτια όπου η εκπεμπόμενη ακτινοβολία δεν μπορούσε να βγει.
Τα ραδιοϊσότοπα χρησιμοποιούνται σε διαφορετικές εφαρμογές λόγω της ικανότητάς τους να εκπέμπουν ακτινοβολία. Για παράδειγμα, τα ραδιοϊσότοπα μπορούν να χρησιμοποιηθούν για την παρακολούθηση διεργασιών όπως η αντιγραφή του DNA ή η μεταφορά αμινοξέων. Στην παραγωγή πυρηνικής ενέργειας χρησιμοποιούνται βαριά ραδιοϊσότοπα.
Διαφορά μεταξύ Ισότοπου και Ραδιοϊσότοπου
Ορισμός
Ισότοπο: Τα ισότοπα είναι διαφορετικές μορφές ατόμων του ίδιου στοιχείου.
Ραδιοϊσότοπο: Ένα ραδιοϊσότοπο είναι ένα ασταθές ισότοπο ενός χημικού στοιχείου που μπορεί να υποστεί ραδιενεργό διάσπαση.
Σταθερότητα
Ισότοπο: Τα ισότοπα μπορεί να είναι είτε σταθερά είτε ασταθή.
Ραδιοϊσότοπο: Τα ραδιοϊσότοπα είναι ασταθή ισότοπα.
Ραδιενέργεια
Ισότοπο: Τα ισότοπα ορισμένων στοιχείων μπορεί να δείχνουν ραδιενέργεια.
Ραδιοϊσότοπο: Τα ραδιοϊσότοπα είναι ουσιαστικά ραδιενεργά.
Παρουσία στη φύση
Ισότοπο: Σταθερά ισότοπα μπορούν να βρεθούν σε στοιχειακή μορφή ή σε συνδυασμό με άλλα στοιχεία στη φύση.
Ραδιοϊσότοπο: Τα ραδιοϊσότοπα μπορούν να βρεθούν στη φύση για σύντομο χρονικό διάστημα.
Χρόνος ημιζωής
Ισότοπο: Τα σταθερά ισότοπα δεν έχουν χρόνο ημιζωής, αλλά τα ασταθή ισότοπα έχουν χρόνο ημιζωής.
Ραδιοϊσότοπο: Τα ραδιοϊσότοπα έχουν πάντα χρόνο ημιζωής.
Συμπέρασμα
Τα ραδιοϊσότοπα είναι ένας τύπος ισοτόπων. Είναι τα ασταθή ισότοπα ενός συγκεκριμένου χημικού στοιχείου. Τα σταθερά ισότοπα δεν υφίστανται ραδιενεργό διάσπαση επειδή μπορούν να υπάρχουν στη φύση ως σταθερές ενώσεις. Όμως τα ραδιοϊσότοπα δεν είναι σταθερά. Επομένως πρέπει να υποστούν ραδιενεργό διάσπαση για να γίνουν σταθερά. Αυτή είναι η κύρια διαφορά μεταξύ του ισοτόπου και του ραδιοϊσοτόπου.




