Διαφορά μεταξύ οργανικού οξέος και ανόργανου οξέος
Κύρια διαφορά – Οργανικό οξύ έναντι ανόργανου οξέος
Γενικά, τα οξέα είναι χημικές ενώσεις που μπορούν να εξουδετερώσουν μια βάση. Ένα οξύ μπορεί να σχηματίσει ιόντα υδρονίου (H3 Ο) όταν προστίθεται στο νερό. Τυπικά, τα οξέα είναι διαβρωτικές ουσίες που είναι υγρές σε θερμοκρασία δωματίου. Τα οξέα μπορούν είτε να δώσουν ιόντα πρωτονίων (Η) στο διάλυμα είτε να δεχτούν ένα ζεύγος ηλεκτρονίων από ενώσεις πλούσιες σε ηλεκτρόνια που υπάρχουν σε ένα διάλυμα. Η κύρια διαφορά μεταξύ οργανικών οξέων και ανόργανων οξέων είναι ότι τα οργανικά οξέα είναι οργανικές ενώσεις με όξινες ιδιότητες και είναι τυπικά αδύναμα οξέα λαμβάνοντας υπόψη ότι τα ανόργανα οξέα είναι ανόργανες ενώσεις με όξινες ιδιότητες και οι περισσότερες από αυτές είναι ισχυρά οξέα.
Βασικές περιοχές που καλύπτονται
1. Τι είναι το οργανικό οξύ;
– Ορισμός, Δομή, Ιδιότητες
2. Τι είναι το Ανόργανο Οξύ
– Ορισμός, Δομή, Ιδιότητες
3. Διαφορά μεταξύ οργανικού οξέος και ανόργανου οξέος
– Σύγκριση βασικών διαφορών
Βασικοί όροι:Οξέα, καρβοξυλικό οξύ, ιόντα υδρονίου, ανόργανα οξέα, ορυκτά οξέα, οργανικά οξέα, τιμή pH, ισχυρά οργανικά οξέα, αδύναμα οργανικά οξέα

Τι είναι το οργανικό οξύ;
Τα οργανικά οξέα είναι οργανικές ενώσεις με όξινες ιδιότητες. Δεδομένου ότι πρόκειται για οργανικές ενώσεις, τα οργανικά οξέα πρέπει να έχουν ένα άτομο άνθρακα στη δομή τους. Ο πιο κοινός τύπος οργανικού οξέος είναι το καρβοξυλικό οξύ . Ο μοριακός τύπος ενός καρβοξυλικού οξέος μπορεί να δοθεί ως RCOOH. Η λειτουργική ομάδα που προκαλεί την όξινη ιδιότητα είναι –COOH. Το άτομο υδρογόνου σε αυτή την ομάδα μπορεί να απελευθερωθεί ως ιόν Η. Αυτό συμβαίνει επειδή το άτομο οξυγόνου είναι πλούσιο σε ηλεκτρόνια και πιο ηλεκτραρνητικό από το άτομο Η. Έτσι, αυτό το άτομο Η μπορεί εύκολα να διαχωριστεί από την ομάδα –COOH.
Λόγω των όξινων χαρακτηριστικών, τα οργανικά οξέα εμφανίζουν τιμή pH που είναι μικρότερη από 7 . Αυτά τα οξέα μπορούν να μετατραπούν σε μπλε κόκκινο χρώμα και έχουν ξινή γεύση. Υπάρχουν δύο τύποι οργανικών οξέων.
- Ισχυρά οργανικά οξέα
- Ασθενή οργανικά οξέα
Ασθενή οξέα υπάρχουν σε ισορροπίες με τη συζευγμένη τους βάση και το ιόν Η+ σε ένα διάλυμα, ενώ τα ισχυρά οξέα είναι πλήρως διαχωρισμένα και δεν έχουν ισορροπίες σε ένα υδατικό διάλυμα. Τα περισσότερα οργανικά οξέα είναι ασθενή οξέα (π.χ. αιθανοϊκό οξύ) λόγω της μερικής διάστασής τους στο νερό. Αλλά σχεδόν όλα τα οργανικά οξέα διαλύονται σε οργανικούς διαλύτες. Η σταθερότητα του ανιόντος που σχηματίζεται μετά τη διάσπαση καθιστά ένα οργανικό οξύ ισχυρό οξύ ή ασθενές οξύ.
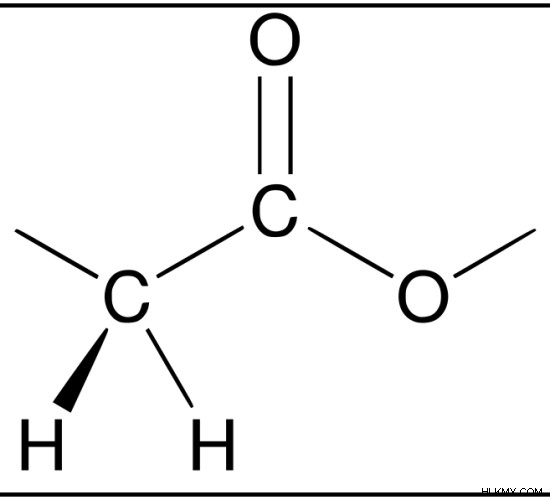
Εικόνα 1:Το οξικό οξύ είναι ένα οργανικό οξύ. Βρίσκεται στο ξύδι.
Τι είναι το Ανόργανο Οξύ;
Τα ανόργανα οξέα είναι ανόργανες ενώσεις με όξινες ιδιότητες. Αυτό σημαίνει ότι οι ενώσεις ανόργανων οξέων μπορούν να δωρίσουν ιόντα Η στο υδατικό διάλυμα ή μπορούν να δεχτούν ζεύγη ηλεκτρονίων από ενώσεις πλούσιες σε ηλεκτρόνια. Τα ανόργανα οξέα ονομάζονται επίσης ορυκτά οξέα . Ορισμένα ανόργανα οξέα έχουν άτομα οξυγόνου στη δομή τους, ενώ ορισμένα ανόργανα οξέα δεν έχουν. Για παράδειγμα, το H2SO4 είναι ένα ανόργανο οξύ που έχει άτομα οξυγόνου. Αλλά το HCN, το οποίο είναι ένα άλλο ανόργανο οξύ, δεν έχει άτομα οξυγόνου.
Σε αντίθεση με τα οργανικά οξέα, τα ανόργανα οξέα δεν έχουν ουσιαστικά άτομο άνθρακα στη δομή τους. Ορισμένα ανόργανα οξέα μπορεί να έχουν άτομα άνθρακα ενώ ορισμένα άλλα ανόργανα οξέα μπορεί να μην έχουν. Για παράδειγμα, το HCN έχει άτομο άνθρακα αν και είναι ανόργανο οξύ. Το HCN δεν είναι οργανικό οξύ επειδή ο μόνος δεσμός C-H που έχει διασπάται εύκολα σε ιόν Η και ιόν CN στο νερό, σε αντίθεση με τις οργανικές ενώσεις.
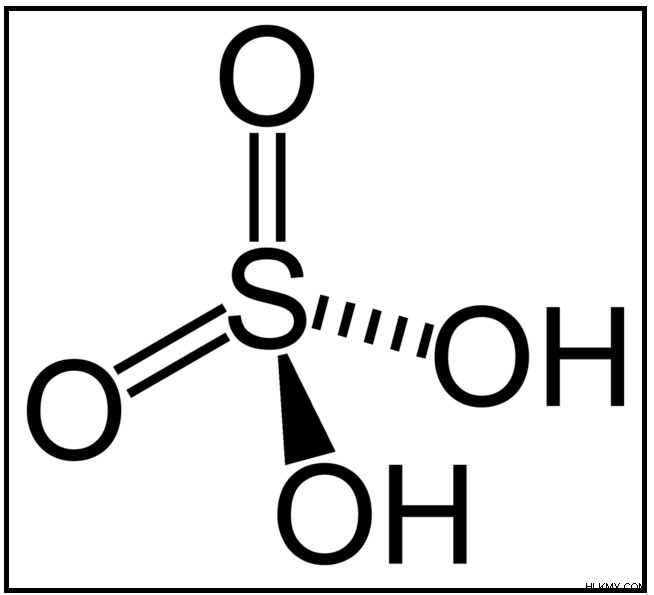
Εικόνα 2:Η δομή του θειικού οξέος, ενός ανόργανου οξέος.
Διαφορά μεταξύ οργανικού οξέος και ανόργανου οξέος
Ορισμός
Οργανικά οξέα: Τα οργανικά οξέα είναι οργανικές ενώσεις με όξινες ιδιότητες.
Ανόργανα οξέα: Τα ανόργανα οξέα είναι ανόργανες ενώσεις με όξινες ιδιότητες.
Προέλευση
Οργανικά οξέα: Τα περισσότερα οργανικά οξέα έχουν βιολογική προέλευση.
Ανόργανα οξέα: Τα περισσότερα ανόργανα οξέα έχουν μη βιολογική προέλευση, όπως ορυκτές πηγές.
Διαλυτότητα στο νερό
Οργανικά οξέα: Τα οργανικά οξέα διαλύονται ελάχιστα στο νερό.
Ανόργανα οξέα: Τα περισσότερα από τα ανόργανα οξέα διαλύονται καλά στο νερό.
Βαθμός οξύτητας
Οργανικά οξέα: Τα οργανικά οξέα είναι συνήθως αδύναμα οξέα.
Ανόργανα οξέα: Τα περισσότερα ανόργανα οξέα είναι ισχυρά οξέα.
Σύνθεση ατόμων
Οργανικά οξέα: Τα οργανικά οξέα έχουν ουσιαστικά άτομα άνθρακα στη δομή τους.
Ανόργανα οξέα: Τα ανόργανα οξέα μπορεί να έχουν ή να μην έχουν άτομα άνθρακα στη δομή τους.
Συμπέρασμα
Τόσο τα οργανικά οξέα όσο και τα ανόργανα οξέα παρουσιάζουν όξινες ιδιότητες όπως εξουδετέρωση βάσεων, δυνατότητα δωρεάς πρωτονίων (ιόντα Η) ή αποδοχής ζεύγη ηλεκτρονίων, μετατροπή της μπλε λυχνίας σε κόκκινο κ.λπ. Και οι δύο ουσίες σχηματίζουν ιόντα υδρονίου (H3 Ο) σε υδατικά διαλύματα. Η κύρια διαφορά μεταξύ οργανικών οξέων και ανόργανων οξέων είναι ότι τα οργανικά οξέα είναι οργανικές ενώσεις ενώ τα ανόργανα οξέα είναι ανόργανες ενώσεις.




