Διαφορά μεταξύ ισομερών διαμόρφωσης και διαμόρφωσης
Κύρια διαφορά – Διαμόρφωση έναντι διαμορφωτικών ισομερών
Ισομέρεια είναι η παρουσία διαφορετικών δομών ή χωρικών διατάξεων για τον ίδιο μοριακό τύπο. Με άλλα λόγια, τα ισομερή μιας συγκεκριμένης ένωσης αποτελούνται από τον ίδιο τύπο ατόμων στην ίδια αναλογία αλλά είναι διαφορετικές ενώσεις λόγω των διαφορών στη συνδεσιμότητα και τη διάταξη αυτών των ατόμων. Η ισομέρεια διαμόρφωσης και διαμόρφωσης είναι δύο τύποι που απαντώνται στις οργανικές ενώσεις. Αυτοί οι δύο τύποι διαφέρουν μεταξύ τους λόγω των περιστροφών τους. Η κύρια διαφορά μεταξύ ισομερών διαμόρφωσης και διαμόρφωσης είναι ότι τα ισομερή διαμόρφωσης δεν μπορούν να ληφθούν περιστρέφοντας το μόριο γύρω από έναν μόνο δεσμό, ενώ τα ισομερή διαμόρφωσης μπορούν να ληφθούν περιστρέφοντας το μόριο γύρω από έναν μόνο δεσμό.
Βασικές περιοχές που καλύπτονται
1. Τι είναι τα ισομερή διαμόρφωσης
– Ορισμός, εξήγηση δομής με παραδείγματα
2. Τι είναι τα διαμορφωτικά ισομερή
– Ορισμός, εξήγηση δομής με παραδείγματα
3. Ποια είναι η διαφορά μεταξύ διαμορφωτικών και διαμορφωτικών ισομερών
– Σύγκριση βασικών διαφορών
Βασικοί όροι:Διαμόρφωση, Διαμόρφωση Ισομερή, Διαμόρφωση, Διαμόρφωση Ισομερή, Έκλειψη Διαμόρφωση, Γεωμετρικά Ισομερή, Ισομερισμός, Οπτικά Ισομερή, Σταδιακή Διαμόρφωση
Τι είναι τα ισομερή διαμόρφωσης
Τα ισομερή διαμόρφωσης είναι στερεοϊσομερή που δεν μπορούν να μετατραπούν το ένα στο άλλο περιστρέφοντας το μόριο γύρω από έναν μόνο δεσμό. Αυτά τα ισομερή διαμόρφωσης μπορούν να βρεθούν σε δύο τύπους, ως γεωμετρικά ισομερή και οπτικά ισομερή.
Γεωμετρικά ισομερή
Τα γεωμετρικά ισομερή ονομάζονται επίσης ισομερή cis-trans. Αυτός ο τύπος ισομερισμού απαντάται κυρίως στα αλκένια και σπάνια στα αλκάνια. Ο γεωμετρικός ισομερισμός περιγράφει την παρουσία δύο όμοιων ομάδων (που συνδέονται με τα άτομα άνθρακα του βινυλίου) που βρίσκονται στην ίδια πλευρά ή στην αντίθετη πλευρά του διπλού δεσμού. Εάν οι δύο ίδιες ομάδες βρίσκονται στην ίδια πλευρά, ονομάζεται cis ισομερές και εάν οι δύο ίδιες ομάδες βρίσκονται στις αντίθετες πλευρές, ονομάζεται trans ισομερές.
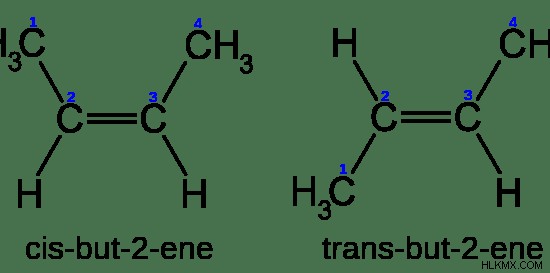
Εικόνα 1:Ισομερισμός Cis-trans
Εδώ, το ένα ισομερές δεν μπορεί να περιστραφεί για να ληφθεί το άλλο ισομερές λόγω της παρουσίας διπλού δεσμού. Ο δεσμός pi απαγορεύει την περιστροφή γύρω από αυτόν.
Οπτικά ισομερή
Ο οπτικός ισομερισμός μπορεί να βρεθεί σε μόρια όπου υπάρχει χειραλικότητα. Χειρικότητα είναι η παρουσία χειρόμορφων ανθράκων που μπορούν να προκαλέσουν την οπτική δραστηριότητα ενός μορίου. Ένας χειρόμορφος άνθρακας είναι ένα άτομο άνθρακα που έχει τέσσερις διαφορετικές ομάδες συνδεδεμένες σε αυτό. Επομένως, η κατοπτρική εικόνα αυτού του μορίου δεν μπορεί να υπερτεθεί με το μόριο.
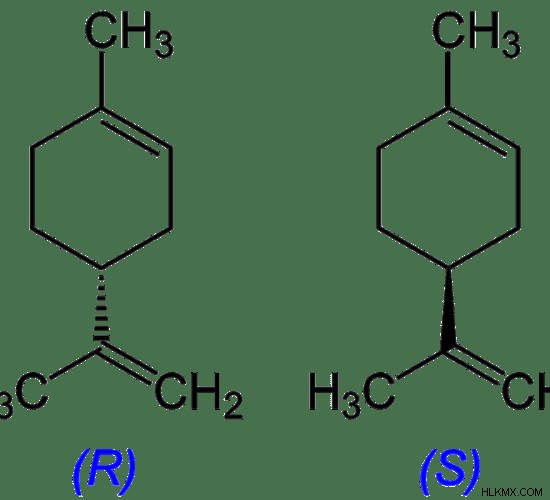
Εικόνα 2:Οπτικός ισομερισμός
Η παραπάνω εικόνα δείχνει δύο οπτικά ισομερή. Αυτά τα ισομερή είναι σε θέση να περιστρέφουν το επίπεδο πολωμένο φως προς αντίθετες κατευθύνσεις. Το ισομερές R μπορεί να περιστρέψει το επίπεδο πολωμένο φως προς την αντίθετη κατεύθυνση που το ισομερές s μπορεί να περιστρέψει το φως. Το γράμμα R υποδηλώνει τη φορά των δεικτών του ρολογιού ενώ το S δείχνει την αριστερόστροφη κατεύθυνση.
Τι είναι τα Conformational Isomers
Τα διαμορφωτικά ισομερή είναι στερεοϊσομερή που μπορούν να μετατραπούν το ένα στο άλλο περιστρέφοντας το μόριο σε έναν μόνο δεσμό. Αυτά τα μόρια ονομάζονται διαμορφωτές. Η διαμόρφωση ενός μορίου δίνεται είτε σε κλιμακωτή διαμόρφωση ή διασκορπισμένη διαμόρφωση . Η διαμόρφωση ενός μορίου είναι ο προσανατολισμός ή η διάταξη των ατόμων ενός μορίου όταν εξετάζεται μέσω του απλού δεσμού που μπορεί να χρησιμοποιηθεί για την περιστροφή του μορίου.
Οι διαμορφώσεις των μορίων σχετίζονται με τις πιθανές ενέργειές τους. Η κλιμακωτή διαμόρφωση έχει ελαχιστοποιημένη τάση μεταξύ των ατόμων. Επομένως, ελαχιστοποιεί τη δυναμική ενέργεια σε αυτό το μόριο. Η επισκιασμένη διαμόρφωση έχει τη μέγιστη τάση μεταξύ των ατόμων. Επομένως, η διαμόρφωση έκλειψης έχει την υψηλότερη δυναμική ενέργεια. Η γωνία μεταξύ των ατόμων σε αυτές τις διαμορφώσεις ονομάζεται διεδρική γωνία. Για κλιμακωτή διαμόρφωση, η διεδρική γωνία είναι 60 ενώ η διεδρική γωνία για τη διαμόρφωση έκλειψης είναι 0.
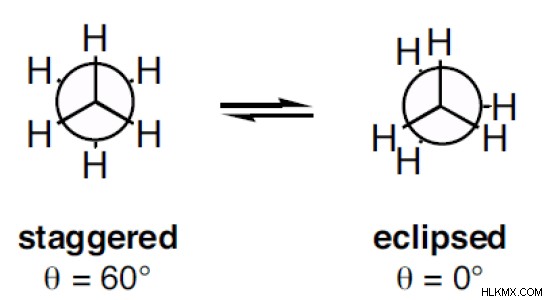
Εικόνα 3:Δύο κύριες διαμορφώσεις του αιθανίου
Επιπλέον, υπάρχουν δύο άλλες διαμορφώσεις που ονομάζονται gauche και anti. Όταν το μόριο έχει έναν υποκαταστάτη, αυτά τα διαμορφωτές μπορούν να φανούν. Η διαμόρφωση gauche έχει μια διεδρική γωνία 60 μεταξύ των υποκαταστατών. Η αντιδιαμόρφωση έχει γωνία 180 δίεδρων.
Εικόνα 4:Gauche, Anti και Ecliped Conformations of Butane
Η παραπάνω εικόνα δείχνει τις διαμορφώσεις gauche, anti και ecliped του βουτανίου. Εδώ, η γωνία μεταξύ δύο ομάδων μεθυλίου είναι η διεδρική γωνία.
Διαφορά μεταξύ ισομερών διαμόρφωσης και διαμόρφωσης
Ορισμός
Ισομερή διαμόρφωσης: Τα ισομερή διαμόρφωσης είναι στερεοϊσομερή που δεν μπορούν να μετατραπούν το ένα στο άλλο περιστρέφοντας το μόριο γύρω από έναν μόνο δεσμό.
Διαμορφωτικά ισομερή: Τα διαμορφωτικά ισομερή είναι στερεοϊσομερή που μπορούν να μετατραπούν το ένα στο άλλο περιστρέφοντας το μόριο σε έναν μόνο δεσμό.
Τύποι ισομερών
Ισομερή διαμόρφωσης: Υπάρχουν δύο τύποι ισομερών διαμόρφωσης ως γεωμετρικά ισομερή και οπτικά ισομερή.
Διαμορφωτικά ισομερή: Υπάρχουν τέσσερις τύποι διαμορφωτικών ισομερών όπως η έκλειψη διαμόρφωση, η κλιμακωτή διαμόρφωση, η διαμόρφωση gauche και η αντιδιαμόρφωση.
Περιστροφή του μορίου
Ισομερή διαμόρφωσης: Η περιστροφή του μορίου γύρω από έναν μόνο δεσμό δεν δίνει το ισομερές του σε ισομερή διαμόρφωσης.
Διαμορφωτικά ισομερή: Η περιστροφή του μορίου γύρω από έναν μόνο δεσμό μπορεί να δώσει πολλαπλά ισομερή σε διαμορφωτικά ισομερή.
Συμπέρασμα
Τα ισομερή διαμόρφωσης και διαμόρφωσης είναι δύο διαφορετικοί τύποι ισομερών. Η κύρια διαφορά μεταξύ ισομερών διαμόρφωσης και διαμόρφωσης είναι ότι τα ισομερή διαμόρφωσης δεν μπορούν να ληφθούν περιστρέφοντας το μόριο γύρω από έναν μόνο δεσμό, ενώ τα ισομερή διαμόρφωσης μπορούν να ληφθούν περιστρέφοντας το μόριο γύρω από έναν μόνο δεσμό.