Διαφορά μεταξύ υδροχλωρικού οξέος και θειικού οξέος
Κύρια διαφορά – Υδροχλωρικό οξύ έναντι θειικού οξέος
Τα οξέα είναι μόρια που είναι ικανά να δωρίσουν πρωτόνια ή ιόντα Η+ σε ένα υδατικό διάλυμα. Υπάρχουν κυρίως δύο τύποι οξέων που ονομάζονται ισχυρά οξέα και αδύναμα οξέα. Το υδροχλωρικό οξύ και το θειικό οξύ είναι δύο ισχυρά οξέα. Η κύρια διαφορά μεταξύ του υδροχλωρικού οξέος και του θειικού οξέος είναι ότι το υδροχλωρικό οξύ είναι μονοπρωτικό ενώ το θειικό οξύ είναι διπρωτικό.
Βασικές περιοχές που καλύπτονται
1. Τι είναι το υδροχλωρικό οξύ
– Ορισμός, Ιδιότητες
2. Τι είναι το θειικό οξύ
– Ορισμός, Ιδιότητες
3. Ποια είναι η διαφορά μεταξύ του υδροχλωρικού οξέος και του θειικού οξέος
– Σύγκριση βασικών διαφορών
Βασικοί όροι:Χημικός τύπος, Διπρωτικός, HCl, H2 SO4 , Υδροχλωρικό Οξύ, Ιονισμός, Μονοπρωτικό, Θειικό Οξύ 
Τι είναι το υδροχλωρικό οξύ
Ένα μόριο υδροχλωρικού οξέος αποτελείται από άτομα υδρογόνου (H) και χλωρίου (Cl). Ο χημικός τύπος του υδροχλωρικού οξέος δίνεται ως HCl . Η μοριακή μάζα του HCl είναι περίπου 36,5 g/mol. Αυτό το οξύ είναι ένα άχρωμο διάλυμα αερίου HCl σε νερό. Δεδομένου ότι είναι ισχυρό οξύ, το HCl είναι διαβρωτικό και θα πρέπει να δίνεται προσοχή κατά τον χειρισμό του.

Εικόνα 01:Υδροχλωρικό οξύ
Το HCl μπορεί να δώσει ένα ιόν Η ανά μόριο HCl, πράγμα που σημαίνει ότι είναι μονοπρωτικό (ικανό να απελευθερώσει ένα πρωτόνιο). Η αντίδραση μεταξύ HCl και νερού μπορεί να δοθεί όπως παρακάτω.
HCl + H2 O → Cl + H3 O
Το HCl έχει μεγάλη σταθερή τιμή διάστασης οξέος (Ka ). Αυτό το οξύ χρησιμοποιείται για τον προσδιορισμό της συγκέντρωσης της βάσης μέσω τιτλοδότησης. Αυτό συμβαίνει επειδή διασπάται εύκολα λόγω του υψηλού Ka και το ιόν Cl σχηματίζει το άλας με το κατιόν της βάσης.
NaOH(aq) + HCl(aq) → NaCl(aq) + H2 O(l)
Στην παραπάνω αντίδραση, το NaOH είναι η βάση και το NaCl είναι το άλας που σχηματίζεται από την αντίδραση.
Εκτός αυτού, το υδροχλωρικό οξύ είναι ένας ήπιος αναγωγικός παράγοντας. Υποβάλλεται σε αντιδράσεις οξειδοαναγωγής με ισχυρούς οξειδωτικούς παράγοντες όπως MnO2 .
MnO2(aq) + HCl(aq) → MnCl2(aq) + Cl2(g) + H2 O(l)
Τι είναι το θειικό οξύ
Το θειικό οξύ είναι ένα ισχυρό οξύ που αποτελείται από άτομα υδρογόνου (H), οξυγόνου (O) και θείου (S). Ο μοριακός τύπος του θειικού οξέος δίνεται ως H2 SO4 . Το θειικό οξύ είναι διπρωτικό οξύ. Αυτό σημαίνει ότι μπορεί να απελευθερώσει δύο πρωτόνια ανά μόριο. Η μοριακή μάζα του θειικού οξέος είναι περίπου 98 g/mol. Είναι μια πολύ διαβρωτική λύση. Αλλά η διαβρωτικότητα εξαρτάται από τη συγκέντρωσή του. Οι πολύ χαμηλές συγκεντρώσεις ενδέχεται να μην είναι επιβλαβείς.
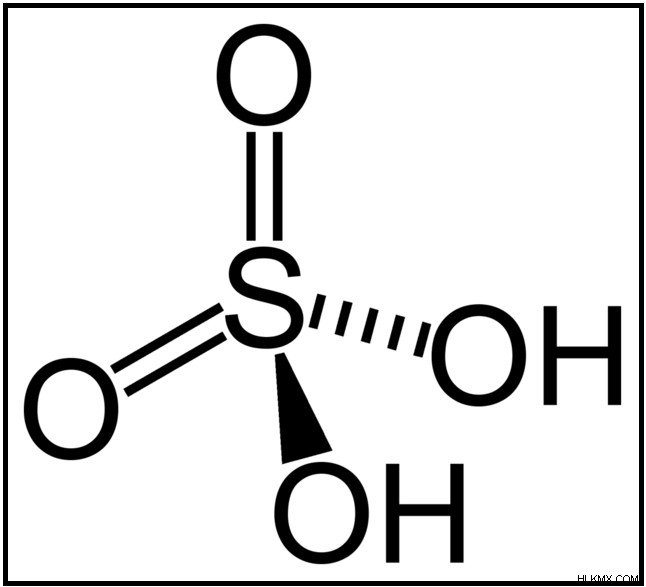
Εικόνα 01:Χημική δομή του θειικού οξέος
Το μόριο του θείου έχει δύο δεσμούς –O-H που είναι πολύ πολικοί. Λόγω αυτής της πολικότητας, τα άτομα Η μπορούν εύκολα να χαθούν. Οιονισμός του θειικού οξέος εμφανίζεται σε δύο στάδια.
H2 SO4(aq) + H2 O(l) → HSO4 (aq) + H3 O(aq)
HSO4 (aq) + H2 O(l) → SO4 (aq) + H3 O(aq)
Το θειικό οξύ είναι ισχυρός οξειδωτικός παράγοντας σε συνθήκες συγκέντρωσης. Όταν όμως αραιώνεται, μειώνεται η οξειδωτική ισχύς. Για παράδειγμα, σε υψηλότερες θερμοκρασίες, το πυκνό θειικό οξύ μπορεί να οξειδώσει το Br σε Br2 .
2HBr(aq) + H2 SO4(aq) → Br2(aq) + SO2(aq) + 2 H2 O(l)
Διαφορά μεταξύ υδροχλωρικού οξέος και θειικού οξέος
Ορισμός
Υδροχλωρικό οξύ: Το υδροχλωρικό οξύ είναι ένα ισχυρό οξύ που αποτελείται από άτομα υδρογόνου και χλωρίου.
Θειικό οξύ: Το θειικό οξύ είναι ένα ισχυρό οξύ που αποτελείται από άτομα υδρογόνου, θείου και οξυγόνου.
Μοριακή μάζα
Υδροχλωρικό οξύ: Η μοριακή μάζα του υδροχλωρικού οξέος είναι περίπου 36,5 g/mol.
Θειικό οξύ: Η μοριακή μάζα του θειικού οξέος είναι περίπου 98 g/mol.
Απελευθέρωση πρωτονίου
Υδροχλωρικό οξύ: Το υδροχλωρικό οξύ είναι μονοπρωτικό και απελευθερώνει ένα πρωτόνιο ανά μόριο.
Θειικό οξύ: Το θειικό οξύ είναι διπρωτικό και απελευθερώνει δύο πρωτόνια ανά μόριο.
Παρουσία ομάδων –OH
Υδροχλωρικό οξύ: Το υδροχλωρικό οξύ δεν έχει ομάδες -ΟΗ.
Θειικό οξύ: Το θειικό οξύ έχει δύο ομάδες –ΟΗ.
Χημικές ιδιότητες
Υδροχλωρικό οξύ: Το υδροχλωρικό οξύ είναι ένας ήπιος αναγωγικός παράγοντας.
Θειικό οξύ: Το θειικό οξύ είναι ισχυρός οξειδωτικός παράγοντας.
Συμπέρασμα
Η κύρια διαφορά μεταξύ του υδροχλωρικού οξέος και του θειικού οξέος είναι ότι το υδροχλωρικό οξύ είναι μονοπρωτικό ενώ το θειικό οξύ είναι διπρωτικό. Τόσο το υδροχλωρικό όσο και το θειικό οξύ είναι πολύ σημαντικά στις εργαστηριακές πρακτικές. Δεδομένου ότι είναι οξέα, θα πρέπει να δίνεται προσοχή κατά το χειρισμό αυτών των διαλυμάτων.




