Διαφορά μεταξύ Valency και Covalency
Κύρια διαφορά – Valency vs Covalency
Ένα άτομο είναι το δομικό στοιχείο της ύλης. Κάθε άτομο αποτελείται από έναν πυρήνα και ένα νέφος ηλεκτρονίων. Ο πυρήνας είναι ο πυρήνας του ατόμου και περιβάλλεται από το νέφος ηλεκτρονίων. Η έννοια του νέφους ηλεκτρονίων εξελίσσεται με βάση την πιθανότητα της θέσης ενός ηλεκτρονίου. Αυτό σημαίνει ότι ένα ηλεκτρόνιο βρίσκεται πάντα σε κίνηση γύρω από τον πυρήνα. Αυτό το μονοπάτι ονομάζεται τροχιακό ή κέλυφος. Τα ηλεκτρόνια λέγεται ότι κινούνται κατά μήκος αυτών των τροχιακών. Το σθένος και το ομοιοπολικό είναι δύο όροι που σχετίζονται με τον αριθμό των ηλεκτρονίων που υπάρχουν σε ένα άτομο. Η κύρια διαφορά μεταξύ σθένους και ομοιοπολικότητας είναι ότι σθένος είναι ο αριθμός των ηλεκτρονίων που θα χάσει ή θα κερδίσει ένα άτομο προκειμένου να σταθεροποιηθεί, ενώ η ομοιοπολικότητα είναι ο μέγιστος αριθμός ομοιοπολικών δεσμών που μπορεί να σχηματίσει ένα άτομο χρησιμοποιώντας τα κενά τροχιακά του .
Βασικές περιοχές που καλύπτονται
1. Τι είναι το Valency
– Ορισμός, Ιδιότητες, Παραδείγματα
2. Τι είναι το Covalency
– Ορισμός, Ιδιότητες, Παραδείγματα
3. Ποια είναι η διαφορά μεταξύ Valency και Covalency
– Σύγκριση βασικών διαφορών
Βασικοί όροι:Atom, Covalency, Covalent Bond, Electron, Orbital, Shell, Valency 
Τι είναι Valency
Το σθένος μπορεί να οριστεί ως ο αριθμός των ηλεκτρονίων που θα χάσει ή θα κερδίσει ένα άτομο προκειμένου να σταθεροποιηθεί. Τα ηλεκτρόνια στο εξώτατο τροχιακό ενός ατόμου είναι γνωστά ως ηλεκτρόνια σθένους. Μερικές φορές, ο αριθμός των ηλεκτρονίων σθένους θεωρείται ως το σθένος αυτού του στοιχείου. Για παράδειγμα, το σθένος του Υδρογόνου (Η) είναι 1 αφού το άτομο υδρογόνου μπορεί να σταθεροποιηθεί είτε χάνοντας είτε κερδίζοντας 1 ηλεκτρόνιο. Το άτομο χλωρίου έχει 7 ηλεκτρόνια στο εξώτατο τροχιακό (ο αριθμός των ηλεκτρονίων σθένους είναι 7), αλλά κερδίζοντας 1 επιπλέον ηλεκτρόνιο, μπορεί να αποκτήσει τη διαμόρφωση ηλεκτρονίων ευγενούς αερίου του αργού (Ar) που είναι πιο σταθερή. Είναι εύκολο να αποκτήσετε ένα ηλεκτρόνιο αντί να χάσετε 7 ηλεκτρόνια, επομένως το σθένος του χλωρίου θεωρείται 1.
Η διαμόρφωση ηλεκτρονίων ενός στοιχείου δίνει το σθένος ενός συγκεκριμένου στοιχείου. Ο παρακάτω πίνακας δείχνει ορισμένα από τα στοιχεία με τα κενά τους.
| Στοιχείο | Διαμόρφωση ηλεκτρονίων | Τα ηλεκτρόνια που πρέπει να ληφθούν ή να απελευθερωθούν για να υπακούουν στον κανόνα της οκτάδας | Σθένος |
| Νάτριο (Na) | 1s2s2p3s | (-)1 | 1 |
| Ασβέστιο (Ca) | 1s2s2p3s3p4s | (-)2 | 2 |
| Άζωτο (Ν) | 1s2s2p | (+)3 | 3 |
| Χλώριο (Cl) | 1s2s2p3s3p | (+)1 | 1 |
Ο παραπάνω πίνακας δείχνει το σθένος ορισμένων στοιχείων. Εκεί, το σημάδι (-) έδειξε τον αριθμό των ηλεκτρονίων που πρέπει να αφαιρεθούν για να σταθεροποιηθούν. Το σημάδι (+) υποδεικνύει τον αριθμό των ηλεκτρονίων που πρέπει να ληφθούν για να σταθεροποιηθούν.

Εικόνα 1:Ο περιοδικός πίνακας στοιχείων
Εκτός αυτού, ο περιοδικός πίνακας στοιχείων μπορεί επίσης να δώσει μια ιδέα για το σθένος ενός στοιχείου. Τα στοιχεία της ομάδας 1 έχουν πάντα σθένος 1 και για τα στοιχεία της ομάδας 2, το σθένος είναι 2.
Τι είναι η ομοιοπολικότητα
Η ομοιοπολικότητα είναι ο μέγιστος αριθμός ομοιοπολικών δεσμών που μπορεί να σχηματίσει ένα άτομο χρησιμοποιώντας τα κενά τροχιακά του. Η ομοιοπολικότητα εξαρτάται από τον αριθμό των ηλεκτρονίων σθένους ενός στοιχείου. Για παράδειγμα, ο αριθμός των ηλεκτρονίων σθένους που υπάρχουν στο Υδρογόνο είναι 1 και η ομοιοπολικότητα του Υδρογόνου είναι επίσης 1, καθώς έχει μόνο ένα ηλεκτρόνιο που μπορεί να μοιραστεί με ένα άλλο άτομο για να σχηματίσει έναν ομοιοπολικό δεσμό.
Αν ληφθεί υπόψη ένα στοιχείο όπως ο άνθρακας, η διαμόρφωση ηλεκτρονίων του άνθρακα είναι 1s2s2p. Ο αριθμός των ηλεκτρονίων σθένους του άνθρακα είναι 4. Έχει κενά τροχιακά p. Επομένως, τα δύο ηλεκτρόνια s σε τροχιακό 2s μπορούν να διαχωριστούν και να συμπεριληφθούν σε αυτά τα τροχιακά p. Τότε υπάρχουν 4 ασύζευκτα ηλεκτρόνια στον άνθρακα. Έτσι, ο άνθρακας έχει 4 ηλεκτρόνια που πρέπει να μοιραστούν προκειμένου να σχηματίσουν ομοιοπολικούς δεσμούς. Επομένως, η ομοιοπολικότητα του άνθρακα είναι 4. Είναι ο μέγιστος αριθμός ομοιοπολικών δεσμών που μπορεί να έχει ένα άτομο άνθρακα. Αυτό εξηγείται από τα τροχιακά διαγράμματα που φαίνονται παρακάτω.
Τα ηλεκτρόνια σθένους του άνθρακα. 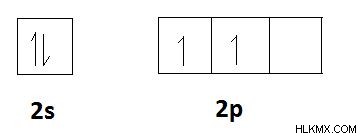
Η εξάπλωση των ηλεκτρονίων στα άδεια τροχιακά. 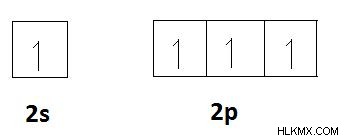
Τώρα υπάρχουν 4 ασύζευκτα ηλεκτρόνια για κοινή χρήση του άνθρακα με άλλα άτομα προκειμένου να σχηματιστούν ομοιοπολικοί δεσμοί.
Διαφορά μεταξύ σθένους και ομοιοπολικότητας
Ορισμός
Σθένος: Σθένος είναι ο αριθμός των ηλεκτρονίων που θα χάσει ή θα κερδίσει ένα άτομο προκειμένου να σταθεροποιηθεί.
Συνενότητα: Η ομοιοπολικότητα είναι ο μέγιστος αριθμός ομοιοπολικών δεσμών που μπορεί να σχηματίσει ένα άτομο χρησιμοποιώντας τα κενά τροχιακά του.
Σχέση με ηλεκτρόνια σθένους
Σθένος: Το σθένος μπορεί να είναι είτε ίσο με τον αριθμό των ηλεκτρονίων σθένους είτε όχι.
Συνενότητα: Η ομοιοπολικότητα εξαρτάται από τον αριθμό των ηλεκτρονίων σθένους.
Κενά τροχιακά
Σθένος: Το Valency δίνει τον αριθμό των ηλεκτρονίων που απαιτούνται για την πλήρωση των κενών τροχιακών.
Συνενότητα: Η ομοιοπολικότητα εξαρτάται από τον αριθμό των κενών τροχιακών που υπάρχουν σε ένα άτομο.
Τύπος συγκόλλησης
Σθένος: Το σθένος μπορεί να δοθεί για στοιχεία που μπορούν να σχηματίσουν είτε ιοντικούς είτε ομοιοπολικούς δεσμούς.
Συνενότητα: Η ομοιοπολικότητα μπορεί να δοθεί μόνο για στοιχεία που μπορούν να σχηματίσουν ομοιοπολικούς δεσμούς.
Συμπέρασμα
Το σθένος μπορεί μερικές φορές να ισούται με τον αριθμό των ηλεκτρονίων σθένους ενός ατόμου, αλλά τις περισσότερες φορές είναι διαφορετικά. Ωστόσο, η ομοιοπολικότητα εξαρτάται πλήρως από τον αριθμό των ηλεκτρονίων σθένους ενός ατόμου. Αυτό συμβαίνει επειδή τα ηλεκτρόνια σθένους καθορίζουν τον αριθμό των ομοιοπολικών δεσμών που μπορεί να έχει ένα άτομο. Επομένως, είναι σημαντικό να γνωρίζετε τη διαφορά μεταξύ σθένους και ομοιοπολικότητας.