Τάση Ηλεκτραρνητικότητας

Η τάση ηλεκτραρνητικότητας αναφέρεται σε μια τάση που μπορεί να δει κανείς στον περιοδικό πίνακα. Αυτή η τάση φαίνεται καθώς μετακινείστε στον περιοδικό πίνακα από αριστερά προς τα δεξιά:η ηλεκτραρνητικότητα αυξάνεται ενώ μειώνεται καθώς μετακινείστε προς τα κάτω μια ομάδα στοιχείων.
Αν και αυτός είναι ο βασικός ορισμός της τάσης ηλεκτραρνητικότητας, για να την κατανοήσουμε πραγματικά, θα ήταν χρήσιμο να την θέσουμε σε μια προοπτική και να δούμε ορισμένα συγκεκριμένα παραδείγματα της τάσης.
Τι είναι μια τάση ηλεκτροαρνητικότητας;
Πριν αρχίσουμε να εξετάζουμε παραδείγματα της τάσης ηλεκτραρνητικότητας, ας ορίσουμε τους όρους μας. Τι είναι ακριβώς η ηλεκτραρνητικότητα; Η ηλεκτροαρνητικότητα αναφέρεται στην ικανότητα ενός ατόμου να προσελκύει τα ηλεκτρόνια που υπάρχουν σε έναν χημικό δεσμό ή στην ικανότητα ενός ατόμου να προσελκύει ηλεκτρόνια όταν αυτό το άτομο είναι μέρος μιας συγκεκριμένης ένωσης. Στις περισσότερες περιπτώσεις, τα ηλεκτρόνια που βρίσκονται μέσα σε έναν χημικό δεσμό έχουν μεγαλύτερη έλξη στο ένα άτομο παρά στο άλλο άτομο, το οποίο δημιουργεί έναν πολικό ομοιοπολικό δεσμό. Αν και μερικές φορές δύο άτομα θα έχουν τις ίδιες ακριβώς τιμές ηλεκτραρνητικότητας και θα έχουν έναν ομοιοπολικό δεσμό, που σημαίνει ότι μοιράζονται εξίσου τα ηλεκτρόνια.
Εάν δύο άτομα έχουν τιμές ηλεκτραρνητικότητας που είναι εξαιρετικά διαφορετικές, δεν θα μοιράζονται καθόλου ηλεκτρόνια μεταξύ τους. Το άτομο με τη μεγαλύτερη τιμή θα πάρει βασικά τον δεσμό ηλεκτρονίων από το άλλο άτομο και θα τον κατέχει, δημιουργώντας έναν ιοντικό δεσμό.
Υπάρχει μια κλίμακα ηλεκτραρνητικότητας που αντανακλά πόσο ισχυρές είναι οι ενέργειες των δεσμών για τα άτομα. Η κλίμακα ονομάζεται Κλίμακα Pauling, που πήρε το όνομά της από τον Linus Pauling που δημιούργησε την κλίμακα το 1932. Η κλίμακα Pauling εκχωρεί τιμές ηλεκτραρνητικότητας ατόμων μεταξύ 0,7 και 3,98. Ως βάση για την κλίμακα χρησιμοποιείται το υδρογόνο και έχει τιμή ηλεκτραρνητικότητας 2,20. Αν και η κλίμακα Pauling είναι η πιο συχνά χρησιμοποιούμενη κλίμακα ηλεκτραρνητικότητας, υπάρχουν και άλλες κλίμακες όπως η κλίμακα Άλεν της κλίμακας Mulliken.
Να θυμάστε ότι η ηλεκτραρνητικότητα εμφανίζεται ως ιδιότητα των ατόμων μέσα στα μόρια και ότι δεν είναι μια ιδιότητα που είναι εγγενής στα ίδια τα άτομα. Για το λόγο αυτό, η τιμή ηλεκτραρνητικότητας μπορεί να αλλάξει ανάλογα με το περιβάλλον στο οποίο βρίσκεται το άτομο. Τις περισσότερες φορές όμως, τα άτομα έχουν παρόμοια συμπεριφορά ακόμη και σε διαφορετικά περιβάλλοντα. Οι παράγοντες που μπορούν να επηρεάσουν την τιμή ηλεκτραρνητικότητας περιλαμβάνουν τον αριθμό των θέσεων ηλεκτρονίων σε ένα άτομο καθώς και το πυρηνικό φορτίο.
Για να το θέσω διαφορετικά, η ηλεκτραρνητικότητα δεν μετριέται σε ένα πρότυπο όπως μονάδες ενέργειας, μετριέται σε σχετική κλίμακα. Αυτό το κάνει διαφορετικό από τη συγγένεια ηλεκτρονίων, επειδή η συγγένεια ηλεκτρονίων αναφέρεται στην πραγματική ενέργεια που απελευθερώνεται όταν τα άτομα καταλήγουν να αποκτούν ένα ηλεκτρόνιο.
Η τάση της ηλεκτροαρνητικότητας
Ως πρακτικό παράδειγμα ηλεκτραρνητικότητας σε δράση, λάβετε υπόψη το γεγονός ότι ένα άτομο χλωρίου έχει υψηλότερη τιμή ηλεκτραρνητικότητας από ένα άτομο υδρογόνου. Η ηλεκτραρνητικότητα του χλωρίου είναι 3,16 ενώ, όπως αναφέρθηκε προηγουμένως, η τιμή ηλεκτραρνητικότητας του υδρογόνου είναι 2,20. Αυτό σημαίνει ότι τα ηλεκτρόνια του δεσμού θα είναι πιο κοντά στο άτομο χλωρίου από το άτομο του υδρογόνου σε ένα μόριο HCl.
Όπως αναφέρθηκε, η τάση ηλεκτραρνητικότητας αναφέρεται στον τρόπο με τον οποίο οι τιμές της ηλεκτραρνητικότητας τείνουν στον περιοδικό πίνακα των στοιχείων. Όταν μετακινούμαστε από αριστερά προς τα δεξιά στον περιοδικό πίνακα, η ηλεκτραρνητικότητα αυξάνεται, με εξαίρεση τα ευγενή αέρια. Γενικά, η ηλεκτραρνητικότητα μειώνεται καθώς μετακινείστε προς τα κάτω σε μια ομάδα στον περιοδικό πίνακα, αυτό συσχετίζεται καθαρά με την αύξηση της απόστασης μεταξύ του πυρήνα του ατόμου και του σθένους των ηλεκτρονίων.
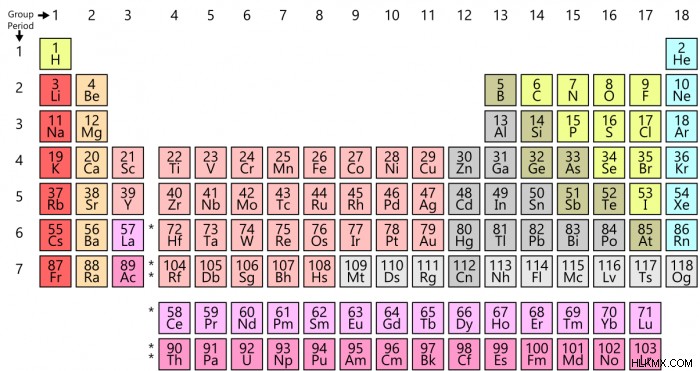
Υπάρχουν επίσης άλλα παραδείγματα εξαιρέσεων από την τάση ηλεκτραρνητικότητας, όπως οι λανθανίδες και οι ακτινίδες. Αυτό ισχύει επειδή τα ευγενή αέρια έχουν συνήθως ένα κέλυφος σθένους που είναι ήδη γεμάτο και επομένως συνήθως δεν μπορούν να προσελκύσουν ηλεκτρόνια. Οι λανθανίδες και οι ακτινίδες είναι απλώς πιο περίπλοκες χημικές ουσίες που δεν ακολουθούν πραγματικά καμία τάση.
Το στοιχείο με την υψηλότερη τιμή ηλεκτραρνητικότητας είναι το φθόριο, το οποίο έχει βαθμολογία 3,98. Το στοιχείο με τη χαμηλότερη ηλεκτραρνητικότητα είναι το καίσιο, το οποίο έχει τιμή 0,79. Δεδομένου ότι το εννοιολογικό αντίθετο της ηλεκτραρνητικότητας είναι η ηλεκτροθετικότητα, θα μπορούσατε επίσης να πείτε ότι το πιο ηλεκτροθετικό στοιχείο είναι το καίσιο. Τα μέταλλα μετάβασης δεν διαφέρουν πολύ, είτε σε όλο το διάγραμμα είτε πάνω-κάτω σε μια ομάδα. Οι τιμές ηλεκτραρνητικότητας για τα μέταλλα μετάπτωσης δεν διαφέρουν πολύ επειδή οι μεταλλικές τους ιδιότητες επηρεάζουν τον τρόπο με τον οποίο προσελκύουν ηλεκτρόνια.
Συγκεκριμένα παραδείγματα Ηλεκτραρνητικότητας:
- Στρόντιο – Το στρόντιο είναι μέταλλο αλκαλικής γαίας με ατομικό αριθμό 38 και σύμβολο Sr. Βρίσκεται στην Ομάδα 2 του περιοδικού πίνακα. Το στρόντιο χρησιμοποιήθηκε συχνά για την κατασκευή γυαλιού για τηλεόραση με καθοδικούς σωλήνες, αν και καθώς οι CRT πέφτουν σε αδυναμία, η χρήση του στροντίου μειώνεται. Καίγεται κόκκινο όταν προστίθεται στα πυροτεχνήματα. Το στρόντιο έχει τιμή ηλεκτραρνητικότητας 0,95.
- Βηρύλλιο – Το βηρύλλιο είναι ένα αρκετά σπάνιο στοιχείο που εμφανίζεται όταν οι κοσμικές ακτίνες συγκρούονται με τους ατομικούς πυρήνες. Έχει τον ατομικό αριθμό 4 και το σύμβολο του είναι Be. Το βηρύλλιο είναι επίσης μέρος της ομάδας 2 στον περιοδικό πίνακα και καθώς βρίσκεται ψηλότερα στο διάγραμμα από το στρόντιο έχει τιμή ηλεκτραρνητικότητας 1,57. Το βηρύλλιο χρησιμοποιείται για την κατασκευή σταθερών αλλά ελαφρών δομικών στοιχείων για αεροσκάφη και δορυφόρους.
- Κοβάλτιο – Το κοβάλτιο είναι ένα μεταβατικό μέταλλο που βρίσκεται στην ομάδα 9 του περιοδικού πίνακα. Ο ατομικός του αριθμός είναι 27 και το σύμβολο του είναι Co. Το κοβάλτιο χρησιμοποιείται συχνά στην κατασκευή μπαταριών ιόντων λιθίου καθώς και μια χρωστική ουσία για το εντυπωσιακό μπλε χρώμα του. Έχει τιμή ηλεκτραρνητικότητας 1,88.
- Ασήμι – Το ασήμι είναι ένα άλλο μεταβατικό μέταλλο και βρίσκεται στην ομάδα 11 του περιοδικού πίνακα. Το χημικό του σύμβολο είναι Ag και έχει ατομικό αριθμό 47. Το ασήμι χρησιμοποιείται για την κατασκευή ημιαγωγών και επίσης σε κοσμήματα. Έχει τιμή ηλεκτραρνητικότητας 1,93.
- Βόριο – Το βόριο είναι ένα μεταλλοειδές που κατασκευάζεται από πτώσεις κοσμικών ακτίνων, έχει ατομικό αριθμό 5 και συμβολίζεται με το σύμβολο Β. Το βόριο χρησιμοποιείται συχνά σε απορρυπαντικά και σε ημιαγωγούς. Χρησιμοποιείται επίσης για την ενίσχυση του fiberglass. Το βόριο βρίσκεται στην ομάδα 13 και έχει τιμή ηλεκτραρνητικότητας 2,04.
- Φώσφορος – Ο φώσφορος είναι ένα αντιδραστικό αμέταλλο που βρίσκεται στην ομάδα 15 του περιοδικού πίνακα. Έχει ατομικό αριθμό 15 και συμβολίζεται με το σύμβολο P. Ο φώσφορος χρησιμοποιείται σε λιπάσματα και σπίρτα. Έχει τιμή ηλεκτραρνητικότητας 2,19. Σημειώστε ότι η παρουσία του στην ομάδα 15, περίοδος 3 του περιοδικού πίνακα αντιστοιχεί στην υψηλότερη ηλεκτραρνητικότητα του από τα στοιχεία που αναφέρθηκαν μέχρι τώρα.
- Υδρογόνο – Το υδρογόνο είναι το στοιχείο γύρω από το οποίο βασίζεται η ηλεκτραρνητικότητα άλλων στοιχείων. Έχει τιμή ηλεκτραρνητικότητας 2,20 και μπορεί να βρεθεί στην ομάδα 1, περίοδος 1. Έχει τον ατομικό αριθμό 1 και αντιπροσωπεύεται από το σύμβολο H. Το υδρογόνο είναι το πιο άφθονο στοιχείο σε ολόκληρο το σύμπαν και χρησιμοποιείται για όλα τα είδη βιομηχανικών διεργασίες όπως ψύξη σταθμών παραγωγής ενέργειας και σταθεροποίηση τμημάτων ημιαγωγών.