Διαφορά μεταξύ d και f στοιχείων μπλοκ
Κύρια διαφορά – d εναντίον f Στοιχεία μπλοκ
Χημικό στοιχείο είναι κάθε υλικό που δεν μπορεί να διασπαστεί ή να αλλάξει με χημικά μέσα. Υπάρχουν 118 γνωστά χημικά στοιχεία. Αυτά τα χημικά στοιχεία είναι τα δομικά στοιχεία της ύλης. Όλα τα χημικά στοιχεία είναι ταξινομημένα στον περιοδικό πίνακα των στοιχείων, με τη σειρά του αυξανόμενου ατομικού αριθμού. Υπάρχουν επίσης τέσσερις ομάδες στοιχείων στον περιοδικό πίνακα:μπλοκ s, μπλοκ p, μπλοκ d και μπλοκ f. Τα στοιχεία ομαδοποιούνται σε αυτές τις ομάδες με βάση τις διαμορφώσεις ηλεκτρονίων τους. Για παράδειγμα, τα στοιχεία μπλοκ s έχουν τα εξωτερικά ηλεκτρόνια τους σε ένα τροχιακό s. Τα στοιχεία μπλοκ p έχουν τα εξωτερικά ηλεκτρόνια τους σε ένα τροχιακό p. Η κύρια διαφορά μεταξύ στοιχείων μπλοκ d και στοιχείων μπλοκ είναι ότι d μπλοκ στοιχεία είναι χημικά στοιχεία με ηλεκτρόνια γεμάτα στα d τροχιακά τους, ενώ τα στοιχεία μπλοκ f είναι χημικά στοιχεία με ηλεκτρόνια γεμάτα στα τροχιακά τους f.
Βασικές περιοχές που καλύπτονται
1. Τι είναι τα d Block Elements
– Ορισμός, Χημικές ιδιότητες
2. Τι είναι τα f Block Elements
– Ορισμός, Χημικές Ιδιότητες, Λανθανίδες και Ακτινίδες
3. Ποια είναι η διαφορά μεταξύ d και f block στοιχείων
– Σύγκριση βασικών διαφορών
Βασικοί όροι:Actinides, Aufbau Principle, d Block, Electron Configuration, f Block, Inner Transition Elements, Lanthanides, Orbitals, Periodic Table

Τι είναι τα d Block Elements
τα στοιχεία d μπλοκ είναι χημικά στοιχεία με ηλεκτρόνια γεμάτα στα d τροχιακά τους. Η πρώτη απαίτηση για ένα στοιχείο να είναι στοιχείο d block είναι η παρουσία d τροχιακών. Στοιχεία που έχουν τουλάχιστον ένα ηλεκτρόνιο στα d τροχιακά τους κατηγοριοποιούνται ως στοιχεία μπλοκ d. Το μπλοκ d του περιοδικού πίνακα βρίσκεται μεταξύ του μπλοκ s και του μπλοκ p.
Ένα σημαντικό γεγονός σχετικά με τα στοιχεία d block είναι ότι έχουν d τροχιακά που είναι μερικώς ή πλήρως γεμάτα με ηλεκτρόνια. Σύμφωνα με την αρχή Aufbau, τα ηλεκτρόνια γεμίζουν τα τροχιακά σύμφωνα με την αύξουσα σειρά των ενεργειών των τροχιακών. Με άλλα λόγια, τα ηλεκτρόνια γεμίζουν το τροχιακό ns πριν γεμίσουν το τροχιακό (n-1) d. Αυτό συμβαίνει επειδή η ενέργεια του ns τροχιακού είναι μικρότερη από το (n-1) d τροχιακό. Στα στοιχεία της πρώτης σειράς του περιοδικού πίνακα, τα ηλεκτρόνια γεμίζουν πρώτα το τροχιακό 4s πριν γεμίσουν το τροχιακό 3d.
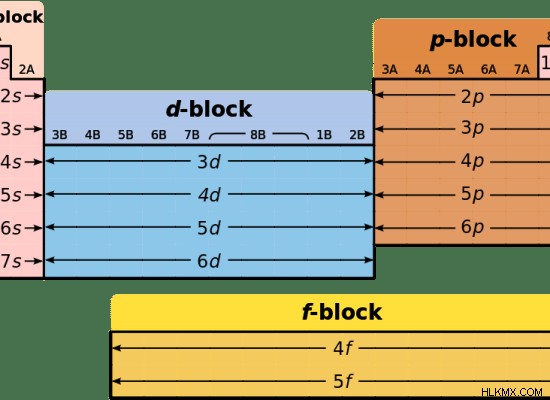
Εικόνα 1:Τέσσερις κύριες ομάδες του περιοδικού πίνακα
Αλλά υπάρχουν και ορισμένες εξαιρέσεις. Αν και το επίπεδο ενέργειας είναι χαμηλότερο, μερικές φορές τα ηλεκτρόνια γεμίζουν τα τροχιακά με την πιο σταθερή διαμόρφωση ηλεκτρονίων. Για παράδειγμα, η διαμόρφωση nsnd είναι πιο σταθερή από την nsnd. Αυτό οφείλεται στη σταθερότητα της πλήρους πλήρωσης των d τροχιακών. Τέτοια δύο παραδείγματα φαίνονται παρακάτω.
Chromium (Cr) = [Ar]3d 4s
Χαλκός (Cu) = [Ar]3d 4s
Όλα τα στοιχεία του μπλοκ είναι μέταλλα. Παρουσιάζουν πολύ υψηλά σημεία τήξης και σημεία βρασμού λόγω των ισχυρών μεταλλικών τους δεσμών. Η μείωση των ατομικών ακτίνων είναι μικρή σε σύγκριση με αυτή των στοιχείων του μπλοκ s και p. Επιπλέον, οι πυκνότητες είναι πολύ υψηλές λόγω της μεταλλικής φύσης. Λόγω της παρουσίας ηλεκτρονίων d, τα στοιχεία μπλοκ d εμφανίζουν μεταβλητές καταστάσεις οξείδωσης.
Τι είναι τα f Block Elements
μπλοκ f Τα στοιχεία είναι χημικά στοιχεία που έχουν ηλεκτρόνια γεμάτα στα f τροχιακά τους. Το μπλοκ f εμφανίζεται στον περιοδικό πίνακα ως ξεχωριστή ομάδα στο κάτω μέρος του περιοδικού πίνακα. Αυτό συμβαίνει επειδή έχουν ηλεκτρόνια που γεμίζουν τα τροχιακά f που καλύπτονται από άλλα τροχιακά. Ως εκ τούτου, τα στοιχεία μπλοκ f είναι γνωστά ως «στοιχεία εσωτερικής μετάβασης ". Η πραγματική θέση του μπλοκ f στον περιοδικό πίνακα είναι μεταξύ του μπλοκ s και του μπλοκ d. Αυτά τα στοιχεία είναι γνωστά ως σπάνια στοιχεία επειδή τα περισσότερα από αυτά τα στοιχεία βρίσκονται σπάνια στη γη.
Υπάρχουν δύο σειρές των στοιχείων μπλοκ f που ονομάζονται ως,
- Σειρά λανθανιδών (τα στοιχεία είναι γνωστά ως Λανθανίδες)
- Σειρά ακτινιδών (τα στοιχεία είναι γνωστά ως ακτινίδες)
Αυτές οι δύο σειρές ονομάζονται ως τέτοιες σύμφωνα με το στοιχείο από το οποίο ξεκινά η σειρά. Η σειρά Lanthanide ξεκινά αμέσως μετά το Lanthanum (La) και η σειρά ακτινιδών ξεκινά με Actinium (Ac). Όλες οι λανθανίδες και οι ακτινίδες είναι μέταλλα.
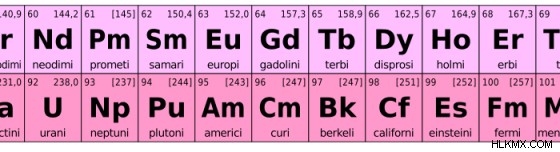
Εικόνα 2:Λανθανίδες και ακτινίδες
Σειρά λανθανίδης
Η σειρά Lanthanide περιέχει 14 στοιχεία που ξεκινούν αμέσως μετά το Lanthanum. Επομένως, αυτή η σειρά περιέχει συνολικά 15 στοιχεία μαζί με το Lanthanum. Ο ατομικός αριθμός της σειράς είναι από το 57 έως το 71. Είναι γνωστές ως «πρώτη εσωτερική μεταβατική σειρά». Οι λανθανίδες ανήκουν στη σειρά 4f αφού αυτά τα στοιχεία έχουν τα ηλεκτρόνια τους να γεμίζουν στα τροχιακά 4f. Όμως, το Lanthanum έχει ένα εντελώς άδειο υποκέλυφος f. Έτσι, τα στοιχεία από το δημήτριο (Ce) έως το λουτέτιο (Lu) θεωρούνται ως οι λανθανίδες.
Τα ηλεκτρόνια 4f αυτών των στοιχείων καλύπτονται πλήρως από άλλα τροχιακά και δεν συμμετέχουν σε κανένα χημικό δεσμό. Οι λανθανίδες είναι ασημί-λευκά μέταλλα και είναι καλοί αγωγοί της θερμότητας. Τα στοιχεία που έχουν πλήρως ή μισογεμισμένα f τροχιακά είναι σταθερά από άλλα στοιχεία της σειράς.
Η πιο σταθερή κατάσταση οξείδωσης που δείχνουν οι Λανθανίδες είναι +3. Ορισμένα στοιχεία εμφανίζουν επίσης καταστάσεις οξείδωσης +2 και +4, αλλά δεν είναι σταθερά ως κατάσταση οξείδωσης +3. Οι λανθανίδες είναι εξαιρετικά δραστικές και μπορούν να αντιδράσουν με στοιχεία όπως υδρογόνο, οξυγόνο, άνθρακας κ.λπ.
Σχεδόν όλα τα ιόντα που σχηματίζονται από τις λανθανίδες είναι άχρωμα. Οι λανθανίδες είναι ηλεκτροθετικά στοιχεία. Ως εκ τούτου, προτιμούν να σχηματίζουν μόρια με ηλεκτραρνητικά στοιχεία. Ωστόσο, σε όλη τη σειρά, οι αλλαγές στις χημικές και φυσικές ιδιότητες είναι πολύ λιγότερες.
Σειρά ακτινιδών
Οι ακτινίδες είναι χημικά στοιχεία που μπορούν να βρεθούν στη σειρά ακτινιδών του μπλοκ f στον περιοδικό πίνακα στοιχείων. Όλες οι ακτινίδες είναι ραδιενεργά στοιχεία λόγω της ασταθούς φύσης τους. Αυτά τα στοιχεία αποτελούνται από πολύ μεγάλα άτομα. Οι ακτινίδες έχουν τα ηλεκτρόνια σθένους τους στο τροχιακό 5f. Η σειρά ακτινιδών αποτελείται από χημικά στοιχεία με ατομικούς αριθμούς 89 έως 103.
Οι πιο κοινές και άφθονες ακτινίδες στη γη είναι το Ουράνιο και το Θόριο. Είναι ασθενώς ραδιενεργά και απελευθερώνουν υψηλή ενέργεια κατά τη διάρκεια της ραδιενεργής αποσύνθεσης. Η έντονη κατάσταση οξείδωσης μεταξύ των ακτινιδών είναι +3. Επιπλέον, οι ακτινίδες εμφανίζουν καταστάσεις οξείδωσης όπως +4, +5 και +6.
Οι ακτινίδες σχηματίζουν βασικά οξείδια και υδροξείδια. Έχουν την ικανότητα να σχηματίζουν σύμπλοκα με συνδέτες όπως χλωρίδια, θειικά κ.λπ. Τα περισσότερα σύμπλοκα ακτινιδών είναι πολύχρωμα. Ωστόσο, λόγω της ραδιενέργειας και της συμπεριφοράς των βαρέων μετάλλων, οι ακτινίδες θεωρούνται τοξικές ενώσεις.
Διαφορά μεταξύ d και f Block Elements
Ορισμός
d Στοιχεία αποκλεισμού: Τα στοιχεία d block είναι χημικά στοιχεία που έχουν ηλεκτρόνια γεμάτα στα d τροχιακά τους.
f Στοιχεία αποκλεισμού: Τα στοιχεία μπλοκ f είναι χημικά στοιχεία που έχουν ηλεκτρόνια γεμάτα στα f τροχιακά τους.
Άλλα ονόματα
d Στοιχεία αποκλεισμού: Τα στοιχεία μπλοκ d είναι γνωστά ως "στοιχεία μετάβασης".
f Στοιχεία αποκλεισμού: Τα στοιχεία μπλοκ f είναι γνωστά ως "στοιχεία εσωτερικής μετάβασης".
Καταστάσεις οξείδωσης
d Στοιχεία αποκλεισμού: Τα στοιχεία d block εμφανίζουν ένα ευρύ φάσμα καταστάσεων οξείδωσης ανάλογα με τις διαμορφώσεις ηλεκτρονίων τους.
f Στοιχεία αποκλεισμού: Η πιο σταθερή κατάσταση οξείδωσης για στοιχεία μπλοκ f είναι +3 και μπορεί να υπάρχουν και άλλες καταστάσεις οξείδωσης.
Σταθερότητα
d Στοιχεία αποκλεισμού: Σχεδόν όλα τα στοιχεία στο μπλοκ d είναι σταθερά.
f Στοιχεία αποκλεισμού: Τα περισσότερα στοιχεία μπλοκ f είναι ραδιενεργά.
Ομάδες
d Στοιχεία αποκλεισμού: Τα στοιχεία μπλοκ d μπορεί να είναι είτε στοιχεία μετάβασης είτε στοιχεία μη μετάβασης.
f Στοιχεία αποκλεισμού: Τα στοιχεία μπλοκ f είναι σε δύο σειρές ως Λανθανίδες και Ακτινίδες.
Διαμόρφωση ηλεκτρονίου
d Στοιχεία αποκλεισμού: Τα στοιχεία d μπλοκ έχουν εν μέρει ή πλήρως γεμίσει τα εξωτερικά d τροχιακά.
f Στοιχεία αποκλεισμού: Τα στοιχεία μπλοκ f ενοποιούνται έχοντας ένα ή περισσότερα από τα εξωτερικά ηλεκτρόνια τους στο τροχιακό f.
Συμπέρασμα
Ο περιοδικός πίνακας στοιχείων δείχνει τη διάταξη όλων των γνωστών χημικών στοιχείων σύμφωνα με τον ατομικό τους αριθμό. Υπάρχουν τέσσερις μεγάλες ομάδες χημικών στοιχείων που έχουν παρόμοιες χημικές και φυσικές ιδιότητες μεταξύ των μελών κάθε ομάδας. Το μπλοκ d και το μπλοκ f είναι δύο ομάδες μεταξύ αυτών των τεσσάρων ομάδων. Η κύρια διαφορά μεταξύ στοιχείων μπλοκ d και στοιχείων μπλοκ είναι ότι τα στοιχεία μπλοκ d είναι χημικά στοιχεία με ηλεκτρόνια γεμάτα στα d τροχιακά τους, ενώ τα στοιχεία μπλοκ f είναι χημικά στοιχεία με ηλεκτρόνια γεμάτα στα τροχιακά τους f.
Αναφορά:
1. «Γενικές ιδιότητες και αντιδράσεις των ακτινιδών». Chemistry LibreTexts, Libretexts, 21 Αυγούστου 2017, Διαθέσιμο εδώ.
2. «Λανθανίδης:Ιδιότητες και αντιδράσεις». Chemistry LibreTexts, Libretexts, 20 Αυγούστου 2017, Διαθέσιμο εδώ.
3. "F-Block Elements:Όλα όσα πρέπει να γνωρίζετε!" Toppr Bytes, 30 Ιουλίου 2017, Διαθέσιμο εδώ.
Εικόνα Ευγενική προσφορά:
1. «Δομή περιοδικού πίνακα» από Sch0013r – Αρχείο:PTable structure.png (CC BY-SA 3.0) μέσω Commons Wikimedia
2. "Περιοδικός πίνακας απλός περίπου" Από τον László Németh – Δική εργασία (CC0) μέσω Commons Wikimedia [Περικοπή]




