Διαφορά μεταξύ μοριακού όγκου και μερικού μοριακού όγκου
Κύρια διαφορά – Μοριακός όγκος έναντι Μερικού Μοριακού Όγκου
Μοριακός όγκος είναι ο όγκος ενός mole μιας ουσίας. Ο μοριακός όγκος συμβολίζεται με το σύμβολο Vm. Σε τυπική θερμοκρασία και πίεση, ο μοριακός όγκος του ιδανικού αερίου είναι 22,4 L/mol. Αλλά για άλλες ουσίες, ο μοριακός όγκος εξαρτάται σε μεγάλο βαθμό από τη θερμοκρασία και την πίεση στην οποία μετράται ο όγκος. Από την άλλη πλευρά, ο μερικός μοριακός όγκος είναι ένας περίπλοκος όρος. Μπορεί να οριστεί ως η συμβολή ενός συστατικού ενός μείγματος στον συνολικό όγκο του μείγματος. Η κύρια διαφορά μεταξύ του μοριακού όγκου και του μερικού μοριακού όγκου είναι ότι ο μοριακός όγκος μιας ουσίας είναι ο όγκος ενός γραμμομοριακού όγκου αυτής της ουσίας, ενώ ο μερικός μοριακός όγκος είναι η αλλαγή στον όγκο ενός μείγματος όταν προστίθεται ένα συστατικό σε αυτό το μείγμα.
Βασικές περιοχές που καλύπτονται
1. Τι είναι Μοριακός Όγκος
– Ορισμός, Μοριακός όγκος ιδανικών αερίων, Μονάδες μέτρησης, Υπολογισμός
2. Τι είναι ο Μερικός Μοριακός Όγκος
– Ορισμός, Εξήγηση με Παράδειγμα
3. Ποια είναι η διαφορά μεταξύ του μοριακού όγκου και του μερικού μοριακού όγκου
– Σύγκριση βασικών διαφορών
Βασικοί όροι:Πυκνότητα, Αιθανόλη, Ιδανικό Αέριο, Μοριακή μάζα, Μοριακός Όγκος, Μερικός Μοριακός Όγκος, Θερμοκρασία, Όγκος

Τι είναι ο Μοριακός Όγκος
Μοριακός όγκος είναι ο όγκος που καταλαμβάνει ένα mole μιας ουσίας σε μια δεδομένη θερμοκρασία και πίεση. Η ουσία μπορεί να είναι σε αέρια, υγρή ή στερεή μορφή. Το χημικό σύμβολο για τον μοριακό όγκο είναι Vm. Ο μοριακός όγκος ενός ιδανικού αερίου σε τυπική θερμοκρασία και πίεση είναι 22,4 L/mol.
Υπολογισμός μοριακού όγκου
Για ιδανική συμπεριφορά, PV = nRT
Οι τυπικές τιμές για τη θερμοκρασία και την πίεση είναι 273 K και 1,00 atm αντίστοιχα. Τότε ο μοριακός όγκος του ιδανικού αερίου είναι,
(1,00 atm) x Vm = (1 mol) x (0,08206 L atm mol K) x (273 K)
Vm = 22,4 L/mol
Η μονάδα SI για τον μοριακό όγκο είναι κυβικά μέτρα ανά mole (m/mol). Αλλά γενικά, τα κυβικά δεκατόμετρα ανά mole (dm/mol) χρησιμοποιούνται για αέρια και κυβικά εκατοστά ανά mole (cm/mol) για υγρά και στερεά.
Μοριακός όγκος =Μοριακή μάζα / Πυκνότητα
Ο μοριακός όγκος μιας ουσίας μπορεί απλά να υπολογιστεί χρησιμοποιώντας την παραπάνω σχέση μέτρησης της μοριακής μάζας και της πυκνότητας της ουσίας. Αλλά αν είναι ένα μείγμα πολλών συστατικών, μπορεί να είναι απλώς το άθροισμα των επιμέρους συστατικών. Ωστόσο, ορισμένα υγρά μείγματα παραβιάζουν αυτήν την έννοια.
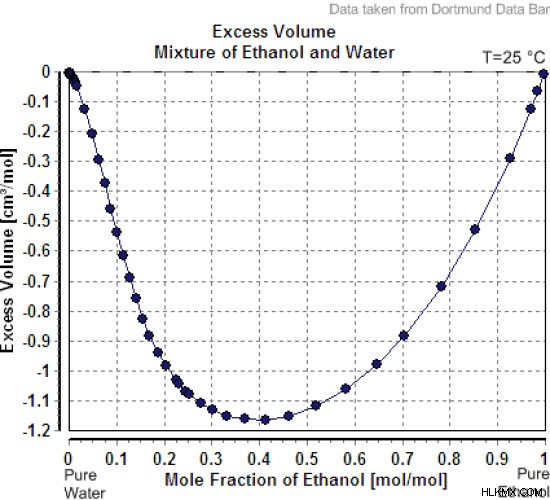
Εικόνα 01:Μείγμα πλεονάζοντος όγκου αιθανόλης και νερού
Για παράδειγμα, όταν το νερό και η αιθανόλη αναμειγνύονται, ο υπολογισμένος μοριακός όγκος δεν είναι το άθροισμα των τιμών των μοριακών όγκων του καθενός. είναι μειωμένη τιμή. Αυτό συμβαίνει λόγω του σχηματισμού διαμοριακών δυνάμεων μεταξύ μορίων νερού και μορίων αιθανόλης.
Τι είναι ο Μερικός Μοριακός Όγκος
Ο μερικός μοριακός όγκος είναι μια θερμοδυναμική ιδιότητα ουσιών που ορίζεται ως η συνεισφορά των συστατικών σε ένα μείγμα για τον συνολικό όγκο του μείγματος. Είναι απλώς η μεταβολή του όγκου όταν προστίθεται ένα mole ενός συστατικού σε ένα μείγμα. Ας εξετάσουμε ένα παράδειγμα για να κατανοήσουμε αυτήν την έννοια.
- Όταν προστίθεται μικρή ποσότητα νερού σε μεγάλη ποσότητα νερού στους 25 C, ο όγκος του νερού αυξάνεται κατά 18,07 cm/mol. Αλλά όταν προστίθεται νερό στην αιθανόλη, ο όγκος του μείγματος αυξάνεται μόνο κατά 14 cm/mol στην ίδια θερμοκρασία και πίεση.
- Αυτό οφείλεται στον σχηματισμό δεσμού υδρογόνου μεταξύ μορίων αιθανόλης και μορίων νερού. Τα μόρια αιθανόλης έχουν ομάδες –ΟΗ που είναι ικανές να σχηματίζουν δεσμούς υδρογόνου. Όταν σχηματίζονται δεσμοί υδρογόνου, τα μόρια πλησιάζουν περισσότερο και ο όγκος μειώνεται από το αναμενόμενο.
- Επομένως, ο μερικός μοριακός όγκος νερού σε αιθανόλη στους 25 C είναι 14 cm/mol.
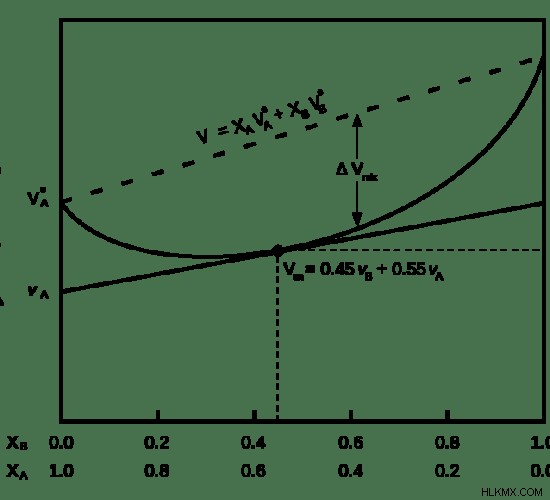
Εικόνα 1:Μια καμπύλη που δείχνει τον μερικό μοριακό όγκο ενός μείγματος.
Η παραπάνω εικόνα δείχνει τον μερικό μοριακό όγκο ενός μείγματος που περιέχει δύο συστατικά:Α και Β. Η διακεκομμένη γραμμή στο γράφημα δείχνει τον αναμενόμενο όγκο. Αλλά ο πραγματικός όγκος έχει μειωθεί κατά ΔVmix .
Διαφορά μεταξύ Μοριακού Όγκου και Μερικού Μοριακού Όγκου
Ορισμός
Μοριακός όγκος: Μοριακός όγκος είναι ο όγκος που καταλαμβάνει ένα mole μιας ουσίας σε μια δεδομένη θερμοκρασία και πίεση.
Μερικός μοριακός όγκος: Ο μερικός μοριακός όγκος είναι μια θερμοδυναμική ιδιότητα των ουσιών που ορίζεται ως η συμβολή των συστατικών σε ένα μείγμα για τον συνολικό όγκο του μείγματος.
Αρχή
Μοριακός όγκος: Μοριακός όγκος είναι ο όγκος μιας ουσίας που μετράται διαιρώντας τη μοριακή μάζα μιας ουσίας με την πυκνότητα αυτής της ουσίας.
Μερικός μοριακός όγκος: Ο μερικός μοριακός όγκος περιγράφει την απροσδόκητη μεταβολή του όγκου όταν μια ουσία προστίθεται σε ένα μείγμα συστατικών.
Ουσίες
Μοριακός όγκος: Ο μοριακός όγκος μπορεί να μετρηθεί για υγρά, στερεά ή αέρια.
Μερικός μοριακός όγκος: Ο μερικός μοριακός όγκος εμφανίζεται με μείγματα υγρού-υγρού.
Συμπέρασμα
Ο μοριακός όγκος και ο μερικός μοριακός όγκος είναι δύο σχετικοί όροι στη θερμοδυναμική. Και οι δύο αυτοί όροι περιγράφουν την αλλαγή στον όγκο ενός συστήματος ανά mole. Η κύρια διαφορά μεταξύ του μοριακού όγκου και του μερικού μοριακού όγκου είναι ότι ο μοριακός όγκος μιας ουσίας είναι ο όγκος ενός mol αυτής της ουσίας, ενώ ο μερικός μοριακός όγκος είναι η αλλαγή στον όγκο ενός μείγματος όταν προστίθεται ένα συστατικό σε αυτό το μείγμα.
Αναφορά:
1. Helmenstine, Anne Marie. "Ορισμός μοριακού όγκου." ThoughtCo, 13 Ιουνίου 2014, Διαθέσιμο εδώ.
2. "Μοριακός όγκος." Wikipedia, Ίδρυμα Wikimedia, 26 Δεκεμβρίου 2017, Διαθέσιμο εδώ.
3. "Μερικός μοριακός όγκος." Μερικός Μοριακός Όγκος – Everyscience.Com, Διαθέσιμο εδώ.
Εικόνα Ευγενική προσφορά:
1. «Υπερβολικός όγκος μίγμα αιθανόλης και νερού» του Wilfried Cordes – de:Dortmunder Datenbank; en:Dortmund Data Bank (CC BY-SA 3.0) μέσω Commons Wikimedia
2. «Μερικός μοριακός όγκος EN» Από Woudloper – Ίδια εργασία (CC BY-SA 3.0) μέσω Commons Wikimedia




