Διαφορά μεταξύ ακετάλης και ημιακετάλης
Κύρια διαφορά – Ακετάλη εναντίον Ημιακετάλης
Η ακετάλη και η ημιακετάλη αναγνωρίζονται ως λειτουργικές ομάδες. Η ημιακετάλη είναι ένα ενδιάμεσο που σχηματίζεται κατά τον σχηματισμό της ακετάλης. Ο σχηματισμός ακετάλης είναι γνωστός ως ακεταλίωση. Εδώ, η αντίδραση μεταξύ μιας αλδεΰδης και μιας αλκοόλης χρησιμοποιείται για τη σύνθεση της ακετάλης. Μερική υδρόλυση της ακετάλης μπορεί επίσης να χρησιμοποιηθεί για να σχηματιστεί ημιακετάλη. Η ακετάλη είναι πιο σταθερή από την ημιακετάλη. Και οι δύο ομάδες αποτελούνται από sp υβριδισμένα άτομα άνθρακα στο κέντρο της ομάδας. Η κύρια διαφορά μεταξύ της ακετάλης και της ημιακετάλης είναι ότι οι ακετάλες περιέχουν δύο ομάδες –OR ενώ οι ημιακετάλες περιέχουν μία ομάδα –OR και μία –ΟΗ.
Βασικές περιοχές που καλύπτονται
1. Τι είναι το Acetal
– Ορισμός, Σχηματισμός
2. Τι είναι το Hemiacetal
– Ορισμός, Σχηματισμός
3. Ποια είναι η διαφορά μεταξύ της ακετάλης και της ημιακετάλης
– Σύγκριση βασικών διαφορών
Βασικοί όροι:Ακετάλη, Ακετάλη, Αλκοόλ, Αλδεΰδη, Ημικετάλη, Ημικετάλη, Κετάλη, Κετόνη

Τι είναι το Acetal
Η ακετάλη είναι μια ομάδα ατόμων που αντιπροσωπεύεται από ένα κεντρικό άτομο άνθρακα συνδεδεμένο με δύο ομάδες –OR, την ομάδα -R και μια ομάδα –Η. Το κεντρικό άτομο άνθρακα υβριδίζεται sp. Οι ομάδες R είναι αλκυλομάδες. Όλες οι ομάδες R μπορεί να είναι ίσες ή διαφορετικές μεταξύ τους. Ο γενικός τύπος μιας ακετάλης μπορεί να δοθεί ως RHC(OR’)2 . Η ακετάλη είναι ένα δίδυμο διαιθερικό παράγωγο μιας αλδεΰδης ή μιας κετόνης.
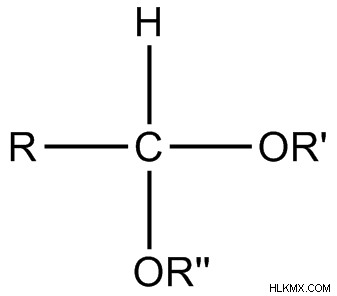
Εικόνα 1:Γενική δομή της ακετάλης
Οι αλκυλομάδες που συνδέονται με άτομα οξυγόνου είναι συχνά παρόμοιες. Το άτομο άνθρακα που φέρει τα δύο άτομα οξυγόνου είναι γνωστό άνθρακας ακετάλης . Η ομάδα ακετάλης θεωρείται ως λειτουργική ομάδα. Κετάλ είναι ένας τύπος ομάδας ακετάλης. Εδώ, το κεντρικό άτομο άνθρακα συνδέεται με δύο ομάδες –OR και δύο ομάδες –R. Δεν υπάρχουν άτομα υδρογόνου συνδεδεμένα με τον κεντρικό άνθρακα εκεί.
Η γεωμετρία γύρω από το κεντρικό άτομο άνθρακα είναι τετραεδρική. Εάν οι δύο ομάδες αλκυλίου που συνδέονται με άτομα οξυγόνου είναι ισοδύναμες, τότε ονομάζεται συμμετρική ακετάλη. Εάν διαφέρουν μεταξύ τους, τότε ονομάζεται μικτή ακετάλη. Αλλά μερικές φορές, ένα από αυτά τα θραύσματα μπορεί να είναι ένα άτομο υδρογόνου παρά μια αλκυλομάδα. Αυτό ονομάζεται ημιακετάλη.
Οι ακετάλες είναι σταθερές σε σύγκριση με τις ημιακετάλες. Ο σχηματισμός ακεταλών είναι γνωστός ως ακεταλίωση . Αυτή η διαδικασία μπορεί να χρησιμοποιηθεί για τον σχηματισμό τόσο ακεταλών όσο και κεταλών. Η πιο κοινή μέθοδος για τον σχηματισμό ακετάλης είναι η πυρηνόφιλη προσθήκη μιας αλκοόλης σε μια αλδεΰδη ή μια κετόνη. Η αντίδραση καταλύεται από οξέα και δίνει νερό ως υποπροϊόν. Το νερό πρέπει να αφαιρεθεί για να ληφθεί η ακετάλη. Διαφορετικά, το νερό μπορεί να υδρολύσει εύκολα την ακετάλη.
Τι είναι η ημιακετάλη
Η ημιακετάλη είναι μια ομάδα ατόμων που αποτελείται από ένα κεντρικό άτομο άνθρακα συνδεδεμένο σε τέσσερις ομάδες:μια ομάδα –OR, ομάδα –ΟΗ, ομάδα –R και ομάδα –Η. Η ημιακετάλη σχηματίζεται από αλδεΰδες. Αν σχηματίζεται από κετόνη, τότε ονομάζεταιημικετάλη . Ο γενικός τύπος μιας ημιακετάλης δίνεται ως RHC(OH)OR’.

Εικόνα 2:Γενική δομή ημιακετάλης
Εδώ, η ομάδα –C-OR αντιπροσωπεύει μια ομάδα αιθέρα ενώ η ομάδα –C-OH αντιπροσωπεύει μια ομάδα αλκοόλης. Επομένως, η ημιακετάλη σχηματίζεται με την προσθήκη αλκοόλης σε μια καρβονυλική ομάδα. Εδώ, η καρβονυλική ομάδα ανήκει σε μια αλδεΰδη. Η ομάδα R είναι μια αλκυλομάδα. Η ομάδα –ΟΗ αλκοόλης μπορεί να επιτεθεί στον άνθρακα καρβονυλίου. Είναι μια πυρηνόφιλη αντίδραση προσθήκης.
Οι ημικετάλες σχηματίζονται ως ενδιάμεσο στο σχηματισμό ακεταλών από αλδεΰδες. Επομένως, οι ημιακετάλες μπορούν επίσης να σχηματιστούν με μερική υδρόλυση μιας ακετάλης. Η αντίδραση μεταξύ ημιακετάλης και αλκοόλης μπορεί να σχηματίσει ακετάλη.
Διαφορά μεταξύ ακετάλης και ημιακετάλης
Ορισμός
Ακετάλη: Η ακετάλη είναι μια ομάδα ατόμων που αντιπροσωπεύεται από ένα κεντρικό άτομο άνθρακα συνδεδεμένο με δύο ομάδες –OR, την ομάδα –R και μια ομάδα –Η.
Ημιακετάλη: Η ημιακετάλη είναι μια ομάδα ατόμων που αποτελείται από ένα κεντρικό άτομο άνθρακα συνδεδεμένο σε τέσσερις ομάδες. μια ομάδα –OR, ομάδα -OH, ομάδα -R και μια ομάδα –H.
Γενικός τύπος
Ακετάλη: Ο γενικός τύπος μιας ακετάλης μπορεί να δοθεί ως RHC(OR’)2 .
Ημιακετάλη: Ο γενικός τύπος μιας ημιακετάλης δίνεται ως RHC(OH)OR’.
Σχηματισμός
Ακετάλη: Η ακετάλη μπορεί να σχηματιστεί από την αντίδραση μεταξύ μιας αλδεΰδης και μιας αλκοόλης.
Ημιακετάλη: Η ημιακετάλη σχηματίζεται ως ενδιάμεσο της αντίδρασης μεταξύ μιας αλδεΰδης και μιας αλκοόλης.
Σταθερότητα
Ακετάλη: Η ακετάλη είναι πιο σταθερή σε σύγκριση με μια ημιακετάλη.
Ημιακετάλη: Η ημιακετάλη είναι λιγότερο σταθερή σε σύγκριση με μια ακετάλη.
Συμπέρασμα
Η ακετάλη και η ημιακετάλη είναι ομάδες ατόμων που θεωρούνται λειτουργικές ομάδες. Υπάρχει μια μικρή διαφορά μεταξύ των χημικών τους δομών. Η κύρια διαφορά μεταξύ της ακετάλης και της ημιακετάλης είναι ότι οι ακετάλες περιέχουν δύο ομάδες –OR, ενώ οι ημιακετάλες περιέχουν μία ομάδα –OR και μία –ΟΗ.
Αναφορά:
1. Helmenstine, Anne Marie. «Ορισμός ακετάλης». ThoughtCo, Διαθέσιμο εδώ.
2. "Ακετάλη." OChemPal, Διαθέσιμο εδώ.
3. «Σχετικά με τις ακετάλες και τις ημιακετάλες». Master Organic Chemistry RSS, Διαθέσιμο εδώ.
Εικόνα Ευγενική προσφορά:
1. «Generic Acetal» Του Jeff Dahl – Δικό έργο (Δημόσιος Τομέας) μέσω Commons Wikimedia
2. "Hemiacetal-2D-skeletal" By Benjah-bmm27 – Δικό του έργο (Δημόσιος Τομέας) μέσω Commons Wikimedia




