Διαφορά μεταξύ υδρογόνωσης και υδρογονόλυσης
Κύρια διαφορά – Υδρογόνωση έναντι υδρογονόλυσης
Η υδρογόνωση και η υδρογονόλυση είναι σημαντικές χημικές αντιδράσεις που συμβαίνουν παρουσία αερίου υδρογόνου και καταλυτών. Αν και τα ονόματα φαίνονται παρόμοια, οι δύο διαδικασίες είναι διαφορετικές μεταξύ τους. Βασικά, η κύρια διαφορά μεταξύ υδρογόνωσης και υδρογονόλυσης είναι ότι η υδρογόνωση περιλαμβάνει τον σχηματισμό μιας κορεσμένης ένωσης από μια ακόρεστη ένωση ενώ η υδρογονόλυση περιλαμβάνει το σχηματισμό δύο μικρών ενώσεων από ένα μεγάλο μόριο.
Βασικές περιοχές που καλύπτονται
1. Τι είναι η Υδρογόνωση
– Ορισμός, Διαδικασία
2. Τι είναι η Υδρογονόλυση
– Ορισμός, Διεργασία, Χρήσεις
3. Ποιες είναι οι ομοιότητες μεταξύ της υδρογόνωσης και της υδρογονόλυσης
– Περίληψη κοινών χαρακτηριστικών
4. Ποια είναι η διαφορά μεταξύ της υδρογόνωσης και της υδρογονόλυσης
– Σύγκριση βασικών διαφορών
Βασικοί όροι:Καταλύτης, Υδρογόνωση, Αέριο Υδρογόνου, Υδρογονόλυση, Κορεσμένο, Ακόρεστο

Τι είναι η υδρογόνωση
Η υδρογόνωση είναι μια χημική αντίδραση που συμβαίνει μεταξύ μοριακού υδρογόνου (H2 ) και ένα άλλο χημικό είδος. Αυτή η αντίδραση λαμβάνει χώρα συνήθως παρουσία ενός καταλύτη όπως το νικέλιο, το παλλάδιο ή η πλατίνα (ή τα οξείδια τους). Η υδρογόνωση χρησιμοποιείται για την αναγωγή και τον κορεσμό μιας χημικής ένωσης. Μπορεί να υπάρχουν δύο τύποι υδρογόνωσης:
- Προσθήκη υδρογόνου σε διπλό ή τριπλό δεσμό σε ένωση
- Προσθήκη υδρογόνου που προκαλεί διάσταση του μορίου
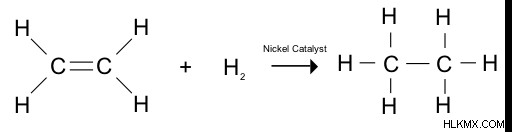
Εικόνα 1:Υδρογόνωση αλκενίου
Σχεδόν όλες οι οργανικές ενώσεις που αποτελούνται από διπλούς δεσμούς ή τριπλούς δεσμούς μπορούν να αντιδράσουν με μοριακό υδρογόνο παρουσία καταλύτη. Η αντίδραση υδρογόνωσης είναι πολύ σημαντική για τις διαδικασίες βιομηχανικής σύνθεσης. για παράδειγμα, στη βιομηχανία πετρελαίου, η υδρογόνωση χρησιμοποιείται για την παραγωγή βενζίνης και διαφόρων πετροχημικών.
Τι είναι η υδρογονόλυση
Η υδρογονόλυση είναι μια αντίδραση διάσπασης όπου το μόριο υδρογόνου (H2 ) αντιδρά με μια οργανική ένωση, με αποτέλεσμα δύο μικρές ενώσεις. Ο δεσμός που διασπάται μπορεί να είναι ένας απλός δεσμός C-C ή ένας απλός δεσμός ετεροατόμου C-X. Το Χ (ετεροάτομο) είναι συνήθως οξυγόνο, άζωτο ή θείο. Αυτή η διαδικασία πραγματοποιείται χρησιμοποιώντας αέριο υδρογόνο παρουσία καταλύτη.
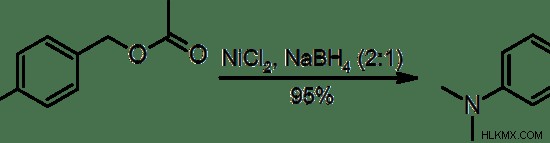
Εικόνα 2:Υδρογονόλυση 4-(διμεθυλαμινο) οξικού βενζυλεστέρα σε Ν,Ν,4-τριμεθυλανιλίνη από βορίδιο νικελίου
Η αντίδραση υδρογονόλυσης έχει εφαρμογές εργαστηριακής κλίμακας καθώς και εφαρμογές βιομηχανικής κλίμακας. Για παράδειγμα, στα εργαστήρια, η υδρογονόλυση χρησιμοποιείται σε αντιδράσεις οργανικής σύνθεσης. π.χ.:αποβενζυλίωση – διάσπαση βενζυλαιθέρων. Ωστόσο, η λειτουργία της υδρογονόλυσης στο εργαστήριο μοιάζει κάπως με την υδρογόνωση. Αυτή η αντίδραση χρησιμοποιείται ευρέως στην πετροχημική βιομηχανία. Χρησιμοποιείται για την αφαίρεση θείου από την πρώτη ύλη στα διυλιστήρια πετρελαίου. Το θείο αφαιρείται με τη μορφή υδρόθειου (H2 ΜΙΚΡΟ).
Ομοιότητες μεταξύ υδρογόνωσης και υδρογονόλυσης
- Και οι δύο αντιδράσεις συμβαίνουν παρουσία μοριακού υδρογόνου.
- Και οι δύο διεργασίες πραγματοποιούνται παρουσία καταλύτη.
Διαφορά μεταξύ υδρογόνωσης και υδρογονόλυσης
Ορισμός
Υδρογόνωση: Η υδρογόνωση είναι μια χημική αντίδραση που συμβαίνει μεταξύ μοριακού υδρογόνου (H2 ) και ένα άλλο χημικό είδος.
Υδρογονόλυση: Η υδρογονόλυση είναι μια αντίδραση διάσπασης κατά την οποία το μόριο υδρογόνου (H2 ) αντιδρά με μια οργανική ένωση με αποτέλεσμα δύο μικρές ενώσεις.
Διαδικασία
Υδρογόνωση: Η υδρογόνωση περιλαμβάνει τη μείωση και τον κορεσμό των χημικών ενώσεων.
Υδρογονόλυση: Η υδρογονόλυση περιλαμβάνει διάσπαση δεσμού.
Χημικός δεσμός
Υδρογόνωση: Η υδρογόνωση λαμβάνει χώρα σε ενώσεις που περιέχουν διπλούς δεσμούς ή τριπλούς δεσμούς.
Υδρογονόλυση: Η υδρογονόλυση λαμβάνει χώρα σε ενώσεις που περιέχουν απλούς δεσμούς C-C ή C-X (ετεροάτομο).
Τελικό προϊόν
Υδρογόνωση: Η υδρογόνωση παράγει μια κορεσμένη ένωση.
Υδρογονόλυση: Η υδρογονόλυση παράγει δύο μικρά μόρια.
Συμπέρασμα
Η υδρογόνωση και η υδρογονόλυση είναι σημαντικές χημικές αντιδράσεις που χρησιμοποιούνται σε εργαστήρια καθώς και σε βιομηχανίες. Η κύρια διαφορά μεταξύ υδρογόνωσης και υδρογονόλυσης είναι ότι η υδρογόνωση περιλαμβάνει το σχηματισμό μιας κορεσμένης ένωσης από μια ακόρεστη ένωση ενώ η υδρογονόλυση περιλαμβάνει το σχηματισμό δύο μικρών ενώσεων από ένα μεγάλο μόριο.
Αναφορά:
1. «Υδρογονόλυση». Wikipedia, Ίδρυμα Wikimedia, 31 Αυγούστου 2017, Διαθέσιμο εδώ.
2. «ΤΕΧΝΟΛΟΓΙΑ ΥΔΡΟΓΟΝΟΛΥΣΗΣ». Johnson Matthey Process Technologies, Διατίθεται εδώ.
3. «Υδρογόνωση». Wikipedia, Ίδρυμα Wikimedia, 24 Ιανουαρίου 2018, Διαθέσιμο εδώ.
Εικόνα Ευγενική προσφορά:
1. "Alkene to alkane" Από Ο αρχικός χρήστης που ανέβασε ήταν ο Robert στα Αγγλικά Wikibooks – Μεταφέρθηκε από τα en.wikibooks στα Commons από τον Adrignola χρησιμοποιώντας CommonsHelper (Δημόσιο Τομέα) μέσω Commons Wikimedia
2. «Hydrogenolysis of a benzylic ester by Nickelbor " By LHcheM – Ίδιο έργο (CC BY-SA 3.0) μέσω Commons Wikimedia




