Σχέση Πίεσης και Θερμοκρασίας
Η σχέση μεταξύ της πίεσης και της θερμοκρασίας ενός αερίου δηλώνεται από τον νόμο της θερμοκρασίας πίεσης του Gay-Lussac. Αυτός ο νόμος δηλώνει ότι η πίεση (P) μιας σταθερής μάζας αερίου που διατηρείται σε σταθερό όγκο είναι κατευθυντικά ανάλογη με τη θερμοκρασία Kelvin (T). Επομένως, καθώς η πίεση ενός συγκεκριμένου συστήματος ανεβαίνει, η θερμοκρασία αυτού του συστήματος ανεβαίνει επίσης και αντίστροφα. Οι νόμοι των αερίων περιγράφουν τη συμπεριφορά των αερίων σε σχέση με την πίεση, τον όγκο, τη θερμοκρασία και την ποσότητα. Τα αέρια είναι μία από τις καταστάσεις της ύλης, είτε συμπιέζονται πολύ σφιχτά είτε διαστέλλονται για να γεμίσουν ένα μεγάλο χώρο.
Βασικές περιοχές που καλύπτονται
1. Τι είναι η Πίεση
– Ορισμός, πίεση αερίου
2. Τι είναι η Θερμοκρασία
– Ορισμός, Μέτρηση
3. Ποια είναι η σχέση πίεσης και θερμοκρασίας
– Ο νόμος του Gay-Lussac
Βασικοί όροι:Αέριο, νόμος του Gay-Lussac, Kelvin, πίεση, θερμοκρασία

Τι είναι η πίεση
Η πίεση είναι μια συνεχής φυσική δύναμη που ασκείται σε ένα αντικείμενο από κάτι που βρίσκεται σε επαφή με αυτό. Υπολογίζεται ως η δύναμη ανά μονάδα επιφάνειας. Όταν εξετάζεται ένας κλειστός θάλαμος αερίου που περιβάλλεται από κενό, η πίεση που ασκεί το αέριο στα τοιχώματα του θαλάμου εξαρτάται από τρεις παράγοντες. Είναι η ποσότητα του αερίου στον θάλαμο, ο όγκος του θαλάμου και η θερμοκρασία του αερίου. Όταν οι άλλες παράμετροι είναι σταθερές, η πίεση στο εσωτερικό του θαλάμου είναι ευθέως ανάλογη με την ποσότητα αερίου στον θάλαμο. είναι αντιστρόφως ανάλογο με τον όγκο του θαλάμου. είναι ευθέως ανάλογο με τη θερμοκρασία του αερίου μέσα στο θάλαμο. Η πίεση ορίζεται στο σχήμα 1.
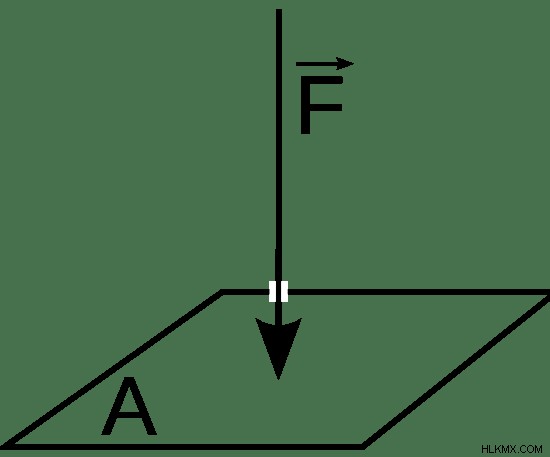
Εικόνα 1:Πίεση
Η ατμοσφαιρική πίεση δημιουργείται από το βάρος του αέρα από πάνω μας. Στο επίπεδο της θάλασσας, είναι 10 Pa.
Τι είναι η θερμοκρασία
Η θερμοκρασία είναι ο βαθμός θερμότητας που υπάρχει σε μια ουσία ή ένα αντικείμενο. Αντιπροσωπεύει την εσωτερική ενέργεια που περιέχεται σε ένα συγκεκριμένο σύστημα. Η θερμοκρασία μπορεί να μετρηθεί με ένα θερμόμετρο, το οποίο βαθμονομείται σε διάφορες μονάδες μέτρησης. Η κλίμακα Κελσίου είναι η πιο ευρέως χρησιμοποιούμενη κλίμακα για τη μέτρηση της θερμοκρασίας, η οποία συμβολίζεται σε °C. Η μονάδα θερμοκρασίας που βασίζεται στο Διεθνές Σύστημα Μονάδων (SI) είναι το Kelvin (K). Ένα θερμόμετρο φαίνεται στο σχήμα 2.

Εικόνα 2:Θερμόμετρο
Στην ψυχρότερη θεωρητική θερμοκρασία, η οποία είναι το απόλυτο μηδέν, η θερμική κίνηση των σωματιδίων σε μια ύλη είναι ελάχιστη. Το απόλυτο μηδέν είναι 0 K και είναι -273,14 °C.
Ποια είναι η σχέση μεταξύ πίεσης και θερμοκρασίας
Η σχέση μεταξύ πίεσης και θερμοκρασίας περιγράφεται σε σχέση με τα αέρια. Ο νόμος του Gay-Lussac είναι ο νόμος των αερίων που περιγράφει τη σχέση πίεσης-θερμοκρασίας. Δηλώνει ότι, σε σταθερό όγκο, η πίεση μιας δεδομένης ποσότητας ενός συγκεκριμένου αερίου είναι ευθέως ανάλογη με τη θερμοκρασία Kelvin του. Μπορεί να γραφτεί ως:
- P ∝ T ή
- P/T =k όπου k είναι σταθερά ή
- P1 /T1 =P2 /T2
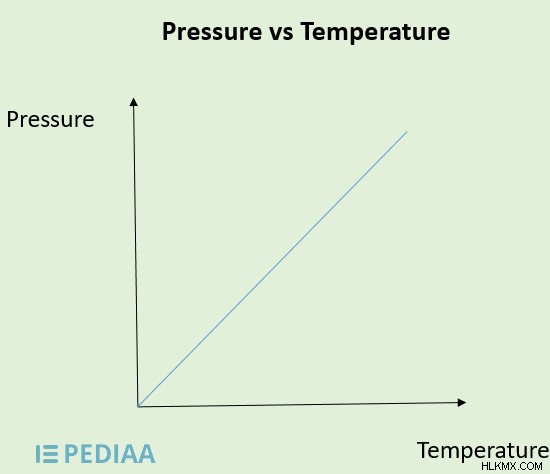
Εικόνα 3:Σχέση μεταξύ πίεσης και θερμοκρασίας
Όταν η θερμοκρασία ενός συγκεκριμένου συστήματος αυξάνεται, τα μόρια του αερίου κινούνται πιο γρήγορα, ασκώντας μεγαλύτερη πίεση στο τοίχωμα του δοχείου αερίου. Αυτό από άποψη αυξάνει την πίεση του συστήματος. Εάν η θερμοκρασία του συστήματος μειωθεί, η πίεση μειώνεται. Επομένως, σε σταθερό όγκο, η πίεση ενός συγκεκριμένου αερίου είναι ευθέως ανάλογη με τη θερμοκρασία.
Συμπέρασμα
Η πίεση μιας δεδομένης ποσότητας αερίου είναι ευθέως ανάλογη με τη θερμοκρασία σε έναν δεδομένο όγκο. Όταν η θερμοκρασία ενός συστήματος ανεβαίνει, ανεβαίνει και η πίεση και το αντίστροφο. Η σχέση μεταξύ πίεσης και θερμοκρασίας ενός αερίου δηλώνεται από το νόμο του Gay-Lussac.
Αναφορά:
1. "9.2 Σχετική πίεση, όγκο, ποσότητα και θερμοκρασία:Ο νόμος του ιδανικού αερίου." Χημεία , Διαθέσιμο εδώ.
Εικόνα Ευγενική προσφορά:
1. «Περιοχή δύναμης πίεσης» του Klaus-Dieter Keller – Δική δουλειά (CC BY-SA 3.0) μέσω Commons Wikimedia
2. “1134182” (CC0) μέσω Pixabay




