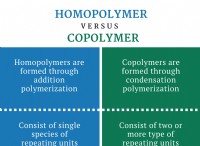
Τι οδηγεί στην αύξηση του ρυθμού χημικής αντίδρασης;
1. Θερμοκρασία:Καθώς αυξάνεται η θερμοκρασία, αυξάνεται η μέση κινητική ενέργεια των μορίων αντιδραστηρίου. Αυτό σημαίνει ότι κινούνται ταχύτερα και συγκρούονται μεταξύ τους πιο συχνά και με περισσότερη ενέργεια, αυξάνοντας τις πιθανότητες μιας επιτυχημένης αντίδρασης.
2. Συγκέντρωση:Η αύξηση της συγκέντρωσης των αντιδραστηρίων σημαίνει ότι υπάρχουν περισσότερα μόρια αντιδραστηρίου που υπάρχουν σε έναν δεδομένο όγκο. Αυτό αυξάνει την πιθανότητα συγκρούσεων μεταξύ των αντιδραστικών μορίων και, κατά συνέπεια, του ρυθμού αντίδρασης.
3. Επιφάνεια:Η αύξηση της επιφάνειας των στερεών ή των υγρών αντιδραστηρίων αυξάνει τον αριθμό των σωματιδίων που εκτίθενται μεταξύ τους και είναι διαθέσιμα για αντίδραση. Αυτό μπορεί να επιταχύνει σημαντικά τον ρυθμό αντίδρασης.
4. Catalyst:Ένας καταλύτης είναι μια ουσία που επιταχύνει μια χημική αντίδραση χωρίς να καταναλώνεται στη διαδικασία. Οι καταλύτες μειώνουν την ενέργεια ενεργοποίησης της αντίδρασης, διευκολύνοντας τα αντιδραστήρια να φτάσουν στη μεταβατική κατάσταση και να σχηματίσουν προϊόντα.
5. Φως:Σε φωτοχημικές αντιδράσεις, η φωτεινή ενέργεια απορροφάται από τα μόρια αντιδραστηρίων, προωθώντας τα σε διεγερμένη κατάσταση. Αυτά τα διεγερμένα μόρια είναι πιο αντιδραστικά και μπορούν να υποβληθούν σε πιο εύκολα αντιδράσεις, αυξάνοντας τον ρυθμό αντίδρασης.
6. Πίεση:Για αντιδράσεις που περιλαμβάνουν αέρια, η αύξηση της πίεσης μπορεί να αυξήσει τον ρυθμό αντίδρασης, αναγκάζοντας περισσότερα μορίων αντιδραστηρίου σε στενότερη εγγύτητα και αυξάνοντας τη συχνότητα των συγκρούσεων.
7. Ενζύμων:Σε βιοχημικές αντιδράσεις, τα ένζυμα δρουν ως καταλύτες για την επιτάχυνση του ρυθμού ειδικών αντιδράσεων. Συνδέονται με τα αντιδραστήρια, σχηματίζοντας ένα σύμπλεγμα ενζύμου-υποβληίου και μειώνουν την ενέργεια ενεργοποίησης που απαιτείται για την εμφάνιση της αντίδρασης.
8. Ιωνική αντοχή:Για αντιδράσεις που περιλαμβάνουν ιόντα σε διάλυμα, η αύξηση της ιοντικής αντοχής του διαλύματος μπορεί να επηρεάσει τον ρυθμό αντίδρασης επηρεάζοντας τη δραστηριότητα και τις αλληλεπιδράσεις των ιόντων.
Είναι σημαντικό να σημειωθεί ότι αυτοί οι παράγοντες μπορούν να έχουν διαφορετικές επιδράσεις σε διαφορετικές αντιδράσεις και η συγκεκριμένη επίδραση εξαρτάται από τη φύση της αντίδρασης και τις συνθήκες υπό τις οποίες εμφανίζεται.