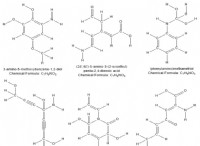
Τι συμβαίνει όταν ένα οξύ αντιδρά με αλκαλικό;
Η γενική εξίσωση για μια αντίδραση εξουδετέρωσης είναι:
Οξύ + αλκαλικό → αλάτι + νερό
Για παράδειγμα, όταν το υδροχλωρικό οξύ (HCl) αντιδρά με υδροξείδιο του νατρίου (NaOH), συμβαίνει η ακόλουθη αντίδραση:
HCl + NaOH → NaCl + H
Σε αυτή την αντίδραση, το υδροχλωρικό οξύ είναι το οξύ και το υδροξείδιο του νατρίου είναι το αλκαλικό. Τα προϊόντα της αντίδρασης είναι χλωριούχο νάτριο (NaCl), το οποίο είναι ένα αλάτι και νερό (h 2 O).
Οι αντιδράσεις εξουδετέρωσης είναι σημαντικές σε πολλές καθημερινές εφαρμογές, όπως:
* Αντοξίδια, τα οποία χρησιμοποιούνται για την εξουδετέρωση του οξέος του στομάχου
* Αποσμητικά, τα οποία χρησιμοποιούνται για την εξουδετέρωση των οσμών του σώματος
* Επεξεργασία νερού, η οποία περιλαμβάνει την απομάκρυνση οξέων και αλκάλων από το νερό για να γίνει ασφαλές για ποτό
Οι αντιδράσεις εξουδετέρωσης είναι επίσης σημαντικές στη χημική βιομηχανία, όπου χρησιμοποιούνται για την παραγωγή ποικίλων προϊόντων, όπως:
* Λιπάσματα
* Σαπούνια
* Απορρυπαντικά
* Χρώματα