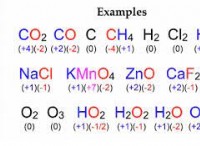
Ποιο είναι το pH του ιωδιούχου αμμωνίου;
NH4I + H2O ⇌ NH4OH + Γεια σας
Η σταθερά ισορροπίας για αυτή την αντίδραση ονομάζεται σταθερά υδρόλυσης (KB). Όσο μεγαλύτερη είναι η τιμή KB, τόσο ισχυρότερη είναι η βάση και όσο υψηλότερο είναι το pH του διαλύματος.
Η τιμή ΚΒ για υδροξείδιο του αμμωνίου είναι 1,8 × 10⁻⁵ στους 25 ° C. Αυτό σημαίνει ότι το υδροξείδιο του αμμωνίου είναι μια σχετικά αδύναμη βάση και το ρΗ των διαλυμάτων ιωδιούχου αμμωνίου θα είναι ελαφρώς όξινο.
Το ρΗ ενός διαλύματος ιωδιούχου αμμωνίου 0,1 Μ μπορεί να υπολογιστεί χρησιμοποιώντας την έκφραση ΚΒ για υδροξείδιο του αμμωνίου:
KB =[NH4OH] [H3O+] / [NH4+]
[NH4OH] =KB × [NH4+] / [H3O+]
Υποθέτοντας την πλήρη διάσπαση του ιωδιούχου αμμωνίου, η συγκέντρωση ιόντων αμμωνίου ([ΝΗ4+]) είναι ίση με τη συγκέντρωση ιωδιούχου αμμωνίου (0,1 Μ).
[NH4OH] =1,8 × 10⁻⁵ × 0,1 m / [H3O+]
[H3O+] =0,1 m / [NH4OH]
[H3O+] =0,1 m / (1,8 × 10⁻⁵ × 0,1 m)
[H3O+] =5.56 × 10⁻⁴ m
ph =-log [H3O+]
ph =-log (5.56 × 10⁻⁴)
ph ≈ 3,25
Επομένως, το ρΗ ενός διαλύματος ιωδιούχου αμμωνίου 0,1 Μ είναι περίπου 3,25, υποδεικνύοντας ένα ελαφρώς όξινο διάλυμα.