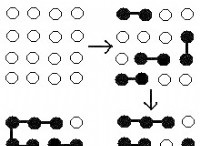
Πώς χρησιμοποιείται ο νόμος για τη μέτρηση της επιθυμητής αντίδρασης;
Νόμος του Hess:
Η αλλαγή ενθαλπίας μιας αντίδρασης είναι ανεξάρτητη από την οδό που λαμβάνεται, πράγμα που σημαίνει ότι είναι η ίδια αν η αντίδραση συμβαίνει σε ένα βήμα ή πολλαπλά βήματα.
Πώς χρησιμοποιείται για τη μέτρηση της ενθαλπίας:
1. Προσδιορίστε γνωστές αλλαγές ενθαλπίας: Βρείτε αντιδράσεις με γνωστές αλλαγές ενθαλπίας (ΔH) που μπορούν να συνδυαστούν για να σχηματίσουν την επιθυμητή αντίδραση. Αυτές οι αντιδράσεις βρίσκονται συχνά σε πίνακες της τυπικής ενθαλπίας του σχηματισμού.
2. Εξισώσεις εξισώσεων: Μπορεί να χρειαστεί:
* Αντίστροφες αντιδράσεις: Εάν αντιστραφεί μια αντίδραση, το σημάδι της ΔH αναστρέφεται.
* Πολλαπλασιάστε τις αντιδράσεις με μια σταθερά: Εάν μια αντίδραση πολλαπλασιαστεί με έναν παράγοντα, το ΔH πολλαπλασιάζεται επίσης με αυτόν τον παράγοντα.
3. Συνδυάστε τις αντιδράσεις: Προσθέστε τις εξισώσεις που χειραγωγούνται μαζί, εξασφαλίζοντας ότι οποιοδήποτε κοινό είδος και στις δύο πλευρές των εξισώσεων ακυρώνει.
4. Υπολογίστε τη συνολική αλλαγή ενθαλπίας: Η μεταβολή της ενθαλπίας της επιθυμητής αντίδρασης (ΔH) είναι το άθροισμα των μεταβολών της ενθαλπίας των μεμονωμένων αντιδράσεων που χρησιμοποιούνται για να το σχηματίσουν.
Παράδειγμα:
Ας πούμε ότι θέλουμε να βρούμε την αλλαγή ενθαλπίας για την ακόλουθη αντίδραση:
c (s) + o2 (g) → CO2 (g) (επιθυμητή αντίδραση)
Γνωρίζουμε τις ακόλουθες αντιδράσεις και τις αλλαγές τους ενθαλπίας:
1.
2.
Για να πάρουμε την επιθυμητή αντίδραση, μπορούμε:
1. αφήστε την αντίδραση 2 όπως είναι.
2. Αντίδραση πολλαπλασιασμού 1 με 2.
Τώρα, ο συνδυασμός των εξισώσεων δίνει:
2C (s) + O2 (g) → 2co (g) ΔH =-221,0 kJ/mol
2CO (g) + o2 (g) → 2co2 (g) ΔH =-566.0 kJ/mol
c (s) + o2 (g) → CO2 (g) ΔH =-787.0 kJ/mol
Επομένως, η αλλαγή ενθαλπίας της επιθυμητής αντίδρασης είναι -787.0 kJ/mol
Βασικά σημεία:
* Ο νόμος του Hess είναι ένα ισχυρό εργαλείο για τον υπολογισμό των αλλαγών ενθαλπίας, ακόμη και για αντιδράσεις που είναι δύσκολες ή αδύνατο να μετρηθούν άμεσα.
* Βασίζεται στην αρχή της διατήρησης της ενέργειας, πράγμα που σημαίνει ότι η συνολική αλλαγή ενθαλπίας για μια αντίδραση είναι η ίδια ανεξάρτητα από το μονοπάτι που λαμβάνεται.
* Η κατανόηση της ενθαλπίας των πινάκων σχηματισμού και ο τρόπος χειρισμού των χημικών εξισώσεων είναι ζωτικής σημασίας για τη χρήση του νόμου του Hess.