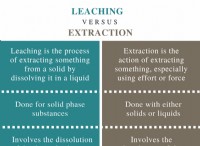
Χημική αντίδραση μεταξύ ασβεστίου και θειικού χαλκού;
αντίδραση:
Ca (s) + cuso₄ (aq) → caso₄ (aq) + cu (s)
Επεξήγηση:
* ασβέστιο (ca) είναι πιο αντιδραστικό από το χαλκός (Cu) Στη σειρά αντιδραστικότητας των μετάλλων. Αυτό σημαίνει ότι το ασβέστιο έχει ισχυρότερη τάση να χάσει ηλεκτρόνια.
* Όταν το μέταλλο ασβεστίου προστίθεται σε ένα διάλυμα θειικού χαλκού, τα άτομα ασβεστίου δίνουν ηλεκτρόνια στα ιόντα χαλκού (Cu2⁺) στο διάλυμα.
* Αυτό προκαλεί τη μείωση των ιόντων χαλκού σε μεταλλικό χαλκό (Cu), το οποίο κατακρημνίζεται από το διάλυμα ως κοκκινωπό-καφέ στερεό.
* Τα άτομα ασβεστίου οξειδώνονται σε ιόντα ασβεστίου (Ca2⁺), τα οποία παραμένουν διαλυμένα στο διάλυμα ως θειικό ασβέστιο (CASO₄).
Παρατηρήσεις:
* Θα παρατηρήσετε ένα κοκκινωπό-καφέ στερεό (χαλκό μέταλλο) που σχηματίζεται στην επιφάνεια του μετάλλου ασβεστίου.
* Το μπλε χρώμα του διαλύματος θειικού χαλκού θα ξεθωριάσει σταδιακά καθώς τα ιόντα χαλκού καταναλώνονται.
Βασικά σημεία:
* Η αντίδραση είναι εξωθερμική, που σημαίνει ότι απελευθερώνει θερμότητα.
* Η αντίδραση οδηγείται από τη διαφορά στην αντιδραστικότητα μεταξύ ασβεστίου και χαλκού.
* Ο σχηματισμός ενός στερεού προϊόντος (χαλκός) καθιστά αυτή την αντίδραση βροχόπτωσης.
ΠΡΟΣΟΧΗ:
* Αυτή η αντίδραση πρέπει να εκτελείται με προσοχή, καθώς μπορεί να είναι έντονη και να παράγει θερμότητα.
* Φορέστε κατάλληλα εργαλεία ασφαλείας, όπως γυαλιά και γάντια.
* Διεξάγετε το πείραμα σε μια καλά αεριζόμενη περιοχή.