Ποια είναι η διαφορά μεταξύ ενός οργανικού χημικού και ανόργανου χημικού;
Οργανικά χημικά:
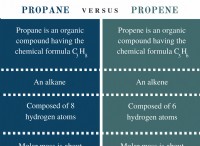
* περιέχει άνθρακα (c) ως κύριο συστατικό: Αυτό είναι το καθοριστικό χαρακτηριστικό.
* συχνά περιέχουν υδρογόνο (h): Αν και δεν υπάρχει πάντοτε παρόν, το υδρογόνο συνήθως βρίσκεται σε οργανικά μόρια.
* συχνά περιέχουν άλλα στοιχεία: Αυτά τα στοιχεία είναι συνήθως μη μεταλλικά όπως οξυγόνο (Ο), άζωτο (Ν), θείο (S), φωσφόρος (Ρ) και αλογόνα.
* μορφή ομοιοπολικών δεσμών: Τα οργανικά μόρια συγκρατούνται από ισχυρούς ομοιοπολικούς δεσμούς.
* τεράστια δομική πολυπλοκότητα: Η οργανική χημεία χαρακτηρίζεται από το σχηματισμό μεγάλων αλυσίδων, δαχτυλιδιών και σύνθετων δομών.
* συνήθως προέρχεται από ζωντανούς οργανισμούς: Πολλές οργανικές ενώσεις βρίσκονται σε φυτά και ζώα.
Παραδείγματα: Σάκχαρα, πρωτεΐνες, λίπη, έλαια, πλαστικά, φυσικό αέριο, πετρέλαιο
ανόργανα χημικά:
* στερείται άνθρακα ως κύριο συστατικό: Ενώ ορισμένες ανόργανες ενώσεις μπορεί να περιέχουν άνθρακα, δεν θεωρούνται οργανικά.
* Μεγάλη ποικιλία στοιχείων: Οι ανόργανες ενώσεις μπορούν να περιέχουν οποιοδήποτε συνδυασμό στοιχείων.
* Συνήθως περιλαμβάνει ιοντικούς δεσμούς: Πολλές ανόργανες ενώσεις σχηματίζονται με τη μεταφορά ηλεκτρονίων μεταξύ των ατόμων, με αποτέλεσμα ιοντικούς δεσμούς.
* απλούστερες δομές: Οι ανόργανες ενώσεις έχουν γενικά απλούστερες δομές από τις οργανικές ενώσεις.
* Βρίσκεται στην κρούστα, την ατμόσφαιρα και τους ωκεανούς της Γης: Πολλές ανόργανες ενώσεις συμβαίνουν φυσικά.
Παραδείγματα: Νερό (H₂O), αλάτι (NaCl), διοξείδιο του άνθρακα (CO₂), μέταλλα (σίδηρος, χρυσός), ορυκτά
Βασικό σημείο: Η διάκριση μεταξύ οργανικής και ανόργανης χημείας δεν είναι απόλυτη. Ορισμένες ενώσεις, όπως το διοξείδιο του άνθρακα (CO₂), μπορούν να θεωρηθούν και οι δύο. Ωστόσο, οι γενικές αρχές που περιγράφονται παραπάνω παρέχουν έναν χρήσιμο τρόπο για τη διαφοροποίηση των δύο κατηγοριών.