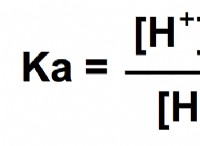Πόσα μόρια οξυγόνου σε 1 λίτρο αέρα;
1. Σύνθεση αέρα
* Ο αέρας είναι περίπου 21% οξυγόνο κατ 'όγκο.
* 1 λίτρο αέρα σε τυπική θερμοκρασία και πίεση (STP) περιέχει περίπου 0,21 λίτρα οξυγόνου.
2. Ιδανικός νόμος αερίου
* Ο νόμος για το ιδανικό αέριο βοηθά στη συσχέτιση του όγκου, της πίεσης, της θερμοκρασίας και του αριθμού των μορίων (moles).
* Ο τύπος είναι:PV =NRT
* P =πίεση (σε ατμόσφαιρες)
* V =όγκος (σε λίτρα)
* n =αριθμός κροταλιών
* R =Ιδανική σταθερά αερίου (0.0821 L · atm/mol · k)
* T =θερμοκρασία (στο Kelvin)
3. Υπολογισμός
* Στο STP:
* P =1 atm
* T =273 K
* V =0,21 L (για οξυγόνο)
* Αντικαταστήστε αυτές τις τιμές στον ιδανικό νόμο για το φυσικό αέριο για να βρείτε τον αριθμό των moles (n):
* (1 atm) * (0.21 L) =n * (0.0821 L · atm/mol · k) * (273 K)
* n ≈ 0.0093 γραμμομόρια οξυγόνου
4. Ο αριθμός του Avogadro
* Ο αριθμός του Avogadro μας λέει πόσα μόρια βρίσκονται σε ένα mole:6.022 x 10^23 μόρια/mole
5. Τελικός υπολογισμός
* Πολλαπλασιάστε τον αριθμό των moles από τον αριθμό του Avogadro:
* (0.0093 moles) * (6.022 x 10^23 μόρια/mole) ≈ 5.6 x 10^21 Μόρια οξυγόνου
Επομένως, υπάρχουν περίπου 5,6 x 10^21 μόρια οξυγόνου σε 1 λίτρο αέρα