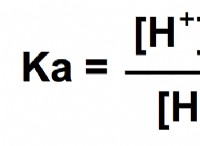Ποιος είναι ο δεσμός σε στερεά μόρια;
1. Ιονικοί δεσμοί: Αυτά σχηματίζονται από την ηλεκτροστατική έλξη μεταξύ των αντίθετα φορτισμένων ιόντων. Τα μεταλλικά άτομα χάνουν ηλεκτρόνια για να γίνουν θετικά φορτισμένα κατιόντα, ενώ τα μη μέταλλα άτομα κερδίζουν ηλεκτρόνια για να γίνουν αρνητικά φορτισμένα ανιόντα. Αυτοί οι δεσμοί είναι συνήθως ισχυροί και οδηγούν σε υψηλά σημεία τήξης και σημεία βρασμού. Παραδείγματα:NaCl (αλάτι τραπεζιού), CAO (οξείδιο του ασβεστίου).
2. ομοιοπολικά ομόλογα: Αυτά περιλαμβάνουν την ανταλλαγή ηλεκτρονίων μεταξύ δύο ατόμων. Τα κοινόχρηστα ηλεκτρόνια προσελκύονται και από τους δύο πυρήνες, δημιουργώντας έναν ισχυρό δεσμό. Οι ομοιοπολικοί δεσμοί μπορούν να είναι ενιαίοι, διπλοί ή τριπλοί, ανάλογα με τον αριθμό των κοινόχρηστων ηλεκτρονίων. Παραδείγματα:Diamond (C), διοξείδιο του πυριτίου (SiO2), νερό (H2O).
3. Μεταλλικοί δεσμοί: Αυτά συμβαίνουν σε μέταλλα και σχηματίζονται από την ηλεκτροστατική έλξη μεταξύ θετικά φορτισμένων μεταλλικών ιόντων και μιας θάλασσας από απομακρυσμένα ηλεκτρόνια. Τα ηλεκτρόνια είναι ελεύθερα να κινούνται σε όλο το μεταλλικό πλέγμα, δίνοντας στα μέταλλα τις χαρακτηριστικές τους ιδιότητες όπως η υψηλή ηλεκτρική και θερμική αγωγιμότητα, η ευελιξία και η ολκιμότητα. Παραδείγματα:Χαλκός (Cu), Χρυσός (AU), Σίδηρος (Fe).
4. Διαμοριακές δυνάμεις: Αυτές είναι ασθενέστερες δυνάμεις που συμβαίνουν μεταξύ των μορίων και είναι υπεύθυνες για τις φυσικές ιδιότητες πολλών ουσιών. Παραδείγματα:δεσμός υδρογόνου στο νερό, δυνάμεις διπολικής-διπολικής στο HCL, Δυνάμεις διασποράς του Λονδίνου στο μεθάνιο.
Εδώ είναι ένας πίνακας που συνοψίζει τους διάφορους τύπους ομολόγων και τα βασικά χαρακτηριστικά τους:
| Τύπος ομολόγων | Χαρακτηριστικά | Παραδείγματα |
| --- | --- | --- |
| Ιωνικός | Ισχυρό, υψηλό σημείο τήξης, εύθραυστο | NACL, CAO |
| Ομοιοπολικό | Ισχυρό, μεταβλητό σημείο τήξης, μη διοργάνωση | Diamond, SiO2, H2O |
| Μεταλλικό | Ισχυρό, υψηλό σημείο τήξης, καλός αγωγός | Cu, Au, Fe |
| Διαμοριακό | Αδύναμο, χαμηλό σημείο τήξης, μεταβλητή αγωγιμότητα | Νερό, HCl, μεθάνιο |
Είναι σημαντικό να σημειωθεί ότι ορισμένα στερεά μπορεί να παρουσιάζουν συνδυασμό διαφορετικών τύπων δεσμών. Για παράδειγμα, ο γραφίτης, μια μορφή άνθρακα, έχει ισχυρούς ομοιοπολικούς δεσμούς μέσα στα στρώματά του αλλά ασθενέστερες διαμοριακές δυνάμεις μεταξύ των στρωμάτων.
Επομένως, η κατανόηση του τύπου του δεσμού που υπάρχει σε ένα στερεό μόριο είναι απαραίτητη για την πρόβλεψη των ιδιοτήτων και της συμπεριφοράς του.