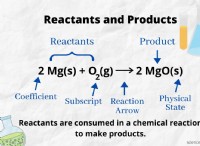
Τι γνωρίζετε για μια χημική ένωση εξετάζοντας τη φόρμουλα της;
1. Στοιχεία που υπάρχουν:
* Τα σύμβολα στον τύπο σας λένε ποια στοιχεία υπάρχουν στην ένωση. Για παράδειγμα, το H₂O μας λέει ότι η ένωση περιέχει υδρογόνο (Η) και οξυγόνο (Ο).
2. Αριθμός ατόμων κάθε στοιχείου:
* Οι δείκτες μετά από κάθε σύμβολο στοιχείου υποδεικνύουν τον αριθμό των ατόμων αυτού του στοιχείου σε ένα μόριο της ένωσης. Εάν δεν υπάρχει δείκτης, είναι κατανοητό ότι είναι 1.
* Το H₂O έχει 2 άτομα υδρογόνου και 1 άτομο οξυγόνου ανά μόριο.
* Το Co₂ έχει 1 άτομο άνθρακα και 2 άτομα οξυγόνου ανά μόριο.
3. Μοριακός τύπος εναντίον εμπειρικής φόρμουλας:
* Μοριακός τύπος: Αντιπροσωπεύει τον πραγματικό αριθμό ατόμων κάθε στοιχείου σε ένα μόριο. (π.χ., h₂o₂ για υπεροξείδιο του υδρογόνου)
* Εμπειρική φόρμουλα: Δείχνει την απλούστερη αναλογία ατόμων σε μια ένωση. (π.χ. HO για υπεροξείδιο του υδρογόνου)
4. Τύπος ένωσης:
* Ιωνικές ενώσεις: Συνήθως έχουν μέταλλο και μη μέταλλο και ο τύπος δείχνει την αναλογία των ιόντων που απαιτούνται για την επίτευξη ηλεκτρικής ουδετερότητας (π.χ., NaCl, MgCl₂).
* ομοιοπολικές ενώσεις: Συνήθως αποτελούνται από μη μέταλλα και συχνά χρησιμοποιούν προθέματα για να υποδείξουν τον αριθμό κάθε στοιχείου (π.χ. co₂, n₂o₄).
5. Πιθανές ιδιότητες (με προειδοποιήσεις):
* Μοριακή μάζα: Μπορείτε να υπολογίσετε τη μοριακή μάζα προσθέτοντας τις ατομικές μάζες κάθε ατόμου στον τύπο. Αυτό σας δίνει μια ιδέα για το βάρος της ένωσης.
* Δομή και συγκόλληση: Μπορούν να συναχθούν ορισμένες βασικές δομικές πληροφορίες. Για παράδειγμα, ένας τύπος όπως το CH₄ προτείνει μια τετραεδρική δομή με τέσσερα άτομα υδρογόνου που συνδέονται με ένα κεντρικό άτομο άνθρακα.
σημαντικοί περιορισμοί:
* Δομή: Οι χημικοί τύποι δεν μεταφέρουν πλήρως τη δομή 3D ενός μορίου.
* Ιδιότητες: Ενώ η μοριακή μάζα μπορεί να δώσει κάποια εικόνα, άλλες ιδιότητες όπως το σημείο τήξης, το σημείο βρασμού και η διαλυτότητα απαιτούν περισσότερες πληροφορίες ή πειραματικά δεδομένα.
Παράδειγμα:
Ας πάρουμε τη φόρμουλα c₆h₁₂o₆ .
* Στοιχεία:άνθρακα (C), υδρογόνο (Η), οξυγόνο (O)
* Αριθμός ατόμων:6 άνθρακα, 12 υδρογόνο, 6 οξυγόνο
* Τύπος:ομοιοπολικό (οργανικό)
* Μοριακή μάζα:~ 180 g/mol (περίπου)
Περαιτέρω εξερεύνηση:
Μπορείτε να χρησιμοποιήσετε χημικούς τύπους για να αναζητήσετε πληροφορίες σχετικά με τις ενώσεις σε βάσεις δεδομένων, εγχειρίδια και επιστημονικά περιοδικά. Αυτοί οι πόροι θα παρέχουν πιο λεπτομερείς πληροφορίες σχετικά με τις ιδιότητες, την αντιδραστικότητα και τις χρήσεις τους.