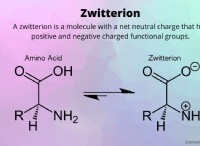
Γιατί η ακετόνη είναι πιο πολική από το αιθυλακετό;
Εδώ είναι γιατί:
* Μοριακή δομή:
* ακετόνη: Έχει μια ομάδα καρβονυλίου (C =O) αλλά είναι συμμετρική. Οι διπολικές στιγμές του δεσμού C =O και των δεσμών C-H ακυρώνουν σε μεγάλο βαθμό σε μεγάλο βαθμό.
* αιθυλακετό: Έχει επίσης μια ομάδα καρβονυλίου, αλλά έχει επίσης μια ομάδα εστέρα (R-Coor '). Αυτό εισάγει μια μεγαλύτερη ροπή διπόλης λόγω της διαφοράς ηλεκτροαρνητικότητας μεταξύ των ατόμων οξυγόνου στην ομάδα του εστέρα και του ατόμου άνθρακα. Η ασυμμετρία του μορίου συμβάλλει περαιτέρω σε μια καθαρή διπολική στιγμή.
* Polarizability: Το αιθυλακετό είναι ένα μεγαλύτερο μόριο από την ακετόνη, που σημαίνει ότι έχει μεγαλύτερο σύννεφο ηλεκτρονίων και είναι πιο πολωμένο.
* δεσμός υδρογόνου: Η ακετόνη δεν μπορεί να σχηματίσει δεσμούς υδρογόνου επειδή στερείται ατόμου υδρογόνου που συνδέεται άμεσα με ένα ηλεκτροαρνητικό άτομο όπως το οξυγόνο ή το άζωτο. Το αιθυλετικό μπορεί να σχηματίσει αδύναμους δεσμούς υδρογόνου με άλλα μόρια που έχουν δότες δεσμού υδρογόνου, όπως το νερό.
Συνοπτικά: Η μεγαλύτερη διπολική ροπή του αιθυλακεικού, η μεγαλύτερη πολωσιμότητα και η ικανότητα σχηματισμού ασθενών δεσμών υδρογόνου συμβάλλουν στην υψηλότερη πολικότητα σε σύγκριση με την ακετόνη.