Τι είναι οι πολικές ουσίες;
Πολικές ουσίες:μια κατάδυση στον κόσμο των ηλεκτρικών διπολών
Οι πολικές ουσίες είναι μόρια που έχουν μόνιμο ηλεκτρικό δίπολο , που σημαίνει ότι διαθέτουν ένα θετικό και αρνητικό τέλος Λόγω της ανομοιόμορφης κατανομής των ηλεκτρονίων. Αυτή η ανομοιόμορφη κατανομή προκύπτει από τις διαφορές στην ηλεκτροαρνητικότητα , η ικανότητα ενός ατόμου να προσελκύει ηλεκτρόνια σε χημικό δεσμό.
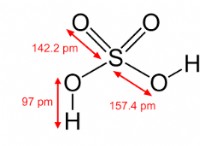
Εδώ είναι μια κατανομή:
1. Ηλεκτροαρνητικότητα και πολικοί δεσμοί:
- Όταν τα άτομα με σημαντικά διαφορετική ηλεκτροαρνητικότητα σχηματίζουν έναν δεσμό, το περισσότερο ηλεκτροαρνητικό άτομο προσελκύει τα κοινά ηλεκτρόνια πιο έντονα, δημιουργώντας ένα μερικό αρνητικό φορτίο (δ-) στον εαυτό του και ένα μερικό θετικό φορτίο (δ+) στο λιγότερο ηλεκτροαρνητικό άτομο.
- Αυτός ο τύπος δεσμού ονομάζεται πολικός ομοιοπολικός δεσμός .
2. Μοριακή γεωμετρία και πολικότητα:
- Ακόμη και αν ένα μόριο περιέχει πολικούς δεσμούς, ίσως να μην είναι πολική συνολικά.
- Η μοριακή γεωμετρία , η τρισδιάστατη διάταξη των ατόμων σε ένα μόριο, παίζει κρίσιμο ρόλο.
- Εάν οι πολικοί δεσμοί είναι διατεταγμένοι συμμετρικά, οι στιγμές διπόλης ακυρώνονται, με αποτέλεσμα ένα μη πολικό μόριο .
- Ωστόσο, εάν οι πολικοί δεσμοί είναι διατεταγμένοι ασύμμετρα, οι στιγμές του διπόλου δεν ακυρώνουν, δημιουργώντας ένα πολικό μόριο .
3. Ιδιότητες πολικών ουσιών:
- Τα πολικά μόρια τείνουν να είναι διαλυτό σε άλλους πολικούς διαλύτες (όπως το νερό), λόγω της έλξης μεταξύ των θετικών και των αρνητικών άκρων των μορίων.
- Έχουν υψηλότερα σημεία βρασμού σε σύγκριση με τα μη πολωτικά μόρια παρόμοιου μεγέθους, λόγω των ισχυρότερων διαμοριακών δυνάμεων (αλληλεπιδράσεις διπολικής-διπόλης και δεσμού υδρογόνου).
Παραδείγματα πολικών ουσιών:
- νερό (h₂o): Το άτομο οξυγόνου είναι πιο ηλεκτροαρνητικό από τα άτομα υδρογόνου, δημιουργώντας μια λυγισμένη γεωμετρία και μια μόνιμη διπολική στιγμή.
- αιθανόλη (c₂h₅oh): Το άτομο οξυγόνου είναι πιο ηλεκτροαρνητικό από τα άτομα άνθρακα και υδρογόνου, οδηγώντας σε ένα πολικό μόριο.
- αμμωνία (NH₃): Το άτομο αζώτου είναι πιο ηλεκτροαρνητικό από τα άτομα υδρογόνου, δημιουργώντας ένα πυραμιδικό σχήμα και ένα πολικό μόριο.
Αντίθετα, μη πολικές ουσίες Έχετε μια συμμετρική κατανομή των ηλεκτρονίων, που δεν οδηγεί σε καμία μόνιμη διπολική στιγμή. Παραδείγματα περιλαμβάνουν:
- μεθάνιο (ch₄): Το άτομο άνθρακα περιβάλλεται από τέσσερα άτομα υδρογόνου σε τετραεδρικό σχήμα, καθιστώντας το μόριο μη πολικό.
- διοξείδιο του άνθρακα (CO₂): Το γραμμικό σχήμα του μορίου με ίση ηλεκτροαρνητικότητα μεταξύ ατόμων άνθρακα και οξυγόνου το καθιστά μη πολικό.
Η κατανόηση της έννοιας των πολικών ουσιών είναι απαραίτητη για την εξήγηση διαφόρων χημικών και φυσικών ιδιοτήτων, όπως η διαλυτότητα, το σημείο βρασμού και οι διαμοριακές αλληλεπιδράσεις.