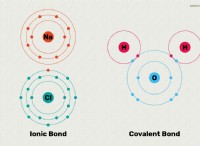
Είναι το Ni3 ομοιοπολικό ή ιοντικό δεσμό;
* Διαφορά ηλεκτροαρνητικότητας: Το άζωτο (Ν) έχει ηλεκτροαρνητικότητα 3,04, ενώ το ιώδιο (Ι) έχει ηλεκτροαρνητικότητα 2,66. Η διαφορά στην ηλεκτροαρνητικότητα μεταξύ τους δεν είναι αρκετά μεγάλη για να δημιουργηθεί ένας ιοντικός δεσμός.
* Φύση της σύνδεσης: Οι ομοιοπολικοί δεσμοί σχηματίζονται όταν τα άτομα μοιράζονται ηλεκτρόνια. Στο Ni₃, το άζωτο μοιράζεται ηλεκτρόνια με κάθε ένα από τα τρία άτομα ιωδίου.
Σημαντική σημείωση: Ενώ το Ni₃ θεωρείται ομοιοπολικό, είναι σημαντικό να θυμόμαστε ότι η διαφορά στην ηλεκτροαρνητικότητα δημιουργεί ένα πολικό ομοιοπολικό δεσμό . Αυτό σημαίνει ότι τα κοινόχρηστα ηλεκτρόνια τραβούν πιο κοντά στο άτομο αζώτου, δίνοντάς του ένα ελαφρώς αρνητικό φορτίο και τα άτομα ιωδίου ένα ελαφρώς θετικό φορτίο.