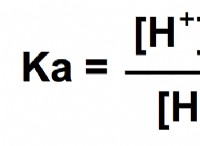Γιατί ένα 1 γραμμομοριακό διάλυμα θειικού οξέος έχει χαμηλότερο ρΗ από το οξικό οξύ;
1. Δύναμη του οξέος:
* θειικό οξύ (h₂so₄): Το θειικό οξύ είναι ένα ισχυρό οξύ . Αυτό σημαίνει ότι πλήρως ιονίζει (διαλύει) σε διάλυμα, απελευθερώνοντας όλα τα ιόντα υδρογόνου (H⁺). Το πρώτο βήμα ιονισμού είναι πολύ ισχυρό και το δεύτερο βήμα ιονισμού είναι επίσης σημαντικό.
* H₂so₄ (aq) → h⁺ (aq) + hso₄⁻ (aq)
* Hso₄⁻ (aq) → h⁺ (aq) + so₄²⁻ (aq)
* οξικό οξύ (ch₃cooh): Το οξικό οξύ είναι ένα αδύναμο οξύ . Μόνο εν μέρει ιονίζει σε διάλυμα, δηλαδή μόνο ένα μικρό κλάσμα των μορίων του απελευθερώνουν ιόντα υδρογόνου.
* Ch₃cooh (aq) ⇌ h⁺ (aq) + ch₃coo⁻ (aq)
2. Επιπτώσεις στο ph:
* Το χαμηλότερο ρΗ σημαίνει υψηλότερη οξύτητα. Όσο περισσότερα ιόντα Η που υπάρχουν σε μια λύση, τόσο χαμηλότερο είναι το ρΗ.
* θειικό οξύ: Επειδή το θειικό οξύ ιονίζεται πλήρως, απελευθερώνει μια πολύ υψηλότερη συγκέντρωση ιόντων Η ίδων στο διάλυμα σε σύγκριση με το οξικό οξύ.
* οξικό οξύ: Λόγω του μερικού ιονισμού του, η συγκέντρωση ιόντων Η σε 1 γραμμικό διάλυμα οξικού οξέος θα είναι σημαντικά χαμηλότερη από ό, τι σε ένα γραμμομοριακό διάλυμα θειικού οξέος 1.
Συνοπτικά:
* Ο πλήρης ιονισμός του θειικού οξέος δημιουργεί μια πολύ υψηλότερη συγκέντρωση ιόντων Η, με αποτέλεσμα χαμηλότερο ρΗ.
* Η μερική ιονισμός του οξικού οξέος οδηγεί σε χαμηλότερη συγκέντρωση ιόντων Η και υψηλότερου ρΗ σε σύγκριση με το θειικό οξύ στην ίδια γραμμομοριακή.