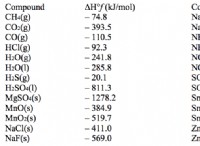
Ποιο είναι το κλάσμα του θειικού οξέος σε ένα διάλυμα με την προσθήκη 3,4 γραμμάρια σε νερό 3500 ml;
1. Υπολογίστε τις γραμμομορείς θειικού οξέος:
* Μοριακή μάζα του h₂so₄: (2 * 1,01 g/mol) + (32,07 g/mol) + (4 * 16,00 g/mol) =98,08 g/mol
* moles του h₂so₄: (3,4 g) / (98,08 g / mol) =0,0347 mol
2. Υπολογίστε τα μολυσματικά του νερού:
* Πυκνότητα νερού: 1 g/mL
* Μάζα νερού: (3500 ml) * (1 g/ml) =3500 g
* Μοριακή μάζα νερού (h₂o): (2 * 1,01 g/mol) + (16,00 g/mol) =18,02 g/mol
* Μοραές νερού: (3500 g) / (18,02 g / mol) =194,3 mol
3. Υπολογίστε το κλάσμα του θειικού οξέος:
* κλάσμα mole (x) =moles διαλυμένου / συνολικού γραμμομόρου διαλύματος
* x (h₂so₄) =0,0347 mol / (0,0347 mol + 194,3 mol) =0,000178
Ως εκ τούτου, το κλάσμα του θειικού οξέος στο διάλυμα είναι περίπου 0,000178.