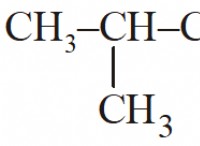Πώς σχετίζεται η ατομική δομή με τα πρότυπα των στοιχείων φυσικών και χημικών ιδιοτήτων που απεικονίζονται στον περιοδικό πίνακα;
1. Αριθμός πρωτονίων (ατομικός αριθμός):
* Ορίζει το στοιχείο: Ο αριθμός των πρωτονίων σε έναν πυρήνα του ατόμου καθορίζει τον ατομικό αριθμό του, ο οποίος είναι το μοναδικό αναγνωριστικό για κάθε στοιχείο.
* Περιοδική οργάνωση πίνακα: Ο περιοδικός πίνακας είναι διατεταγμένος κατά σειρά αύξησης του ατομικού αριθμού, αντανακλώντας τον αυξανόμενο αριθμό πρωτονίων.
2. Αριθμός ηλεκτρονίων:
* Χημική αντιδραστικότητα: Τα ηλεκτρόνια, ιδιαίτερα εκείνα του εξωτερικού κελύφους (ηλεκτρόνια σθένους), καθορίζουν πώς ένα άτομο θα αλληλεπιδράσει με άλλα άτομα και θα σχηματίσει χημικούς δεσμούς.
* Περιοδικές τάσεις:
* ενέργεια ιονισμού: Η ενέργεια που απαιτείται για την απομάκρυνση ενός ηλεκτρονίου από ένα άτομο αυξάνεται σε μια περίοδο (λόγω της αύξησης του πυρηνικού φορτίου που προσελκύει τα ηλεκτρόνια πιο έντονα) και μειώνεται κάτω από μια ομάδα (λόγω της αυξανόμενης θωράκισης ηλεκτρονίων).
* συγγένεια ηλεκτρονίων: Η τάση ενός ατόμου να κερδίσει ένα ηλεκτρόνιο αυξάνεται γενικά σε μια περίοδο και μειώνεται κάτω από μια ομάδα, με κάποιες εξαιρέσεις.
* Ηλεκτροργατιστικότητα: Η ικανότητα ενός ατόμου να προσελκύει ηλεκτρόνια σε έναν δεσμό αυξάνεται σε μια περίοδο και μειώνεται κάτω από μια ομάδα.
3. Αριθμός κελύφων ηλεκτρονίων:
* Περιοδικές τάσεις:
* Ατομικό μέγεθος: Η ατομική ακτίνα γενικά μειώνεται σε μια περίοδο (λόγω της αύξησης των πυρηνικών φορτίων που τραβούν τα ηλεκτρόνια πιο κοντά) και αυξάνεται κάτω από μια ομάδα (λόγω της προσθήκης ηλεκτρονίων κελύφη).
* Μεταλλικός χαρακτήρας: Τα στοιχεία στις αριστερές ομάδες (αλκαλικά και αλκαλικά μέταλλα γης) έχουν χαμηλές ενέργειες ιονισμού και τείνουν να χάνουν ηλεκτρόνια εύκολα, παρουσιάζοντας μεταλλικό χαρακτήρα. Αυτός ο χαρακτήρας μειώνεται σε μια περίοδο.
4. Διάταξη ηλεκτρονίων (διαμόρφωση ηλεκτρονίων):
* Χημική σύνδεση: Η διάταξη των ηλεκτρονίων σε κελύφη και υποβρύχια καθορίζει τον αριθμό και τον τύπο των χημικών δεσμών που μπορεί να σχηματιστεί ένα στοιχείο.
* Κανόνας οκτάδων: Τα άτομα τείνουν να κερδίζουν, να χάνουν ή να μοιράζονται ηλεκτρόνια για να επιτύχουν μια σταθερή διαμόρφωση 8 ηλεκτρονίων σθένους.
* Περιοδικές ομάδες: Τα στοιχεία της ίδιας ομάδας έχουν παρόμοιες διαμορφώσεις ηλεκτρονίων στο κέλυφος σθένους τους, οδηγώντας σε παρόμοιες χημικές ιδιότητες.
Συνοπτικά:
Η ατομική δομή ενός στοιχείου παρέχει το σχέδιο για τη συμπεριφορά του. Ο αριθμός των πρωτονίων, των ηλεκτρονίων και της διάταξης αυτών των σωματιδίων σε κελύφη και υποβρύχια καθορίζουν τις φυσικές και χημικές ιδιότητες που παρατηρούμε σε στοιχεία. Ο περιοδικός πίνακας παρέχει ένα πλαίσιο για την κατανόηση αυτών των σχέσεων, επιτρέποντάς μας να προβλέψουμε και να εξηγήσουμε τις ιδιότητες των στοιχείων που βασίζονται στη θέση τους στον πίνακα.