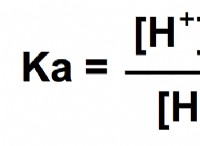Ποιο είναι το επίπεδο pH του 1 μοριακού θειικού οξέος;
Κατανόηση του θειικού οξέος
* Ισχυρό οξύ: Το θειικό οξύ (H₂so₄) είναι ένα ισχυρό οξύ. Αυτό σημαίνει ότι εντελώς ιονίζει (διαχωρίζεται) στο νερό.
* Διπρωτικό οξύ: Το θειικό οξύ έχει δύο όξινα πρωτόνια (ιόντα Η) που μπορούν να δοθούν.
Βήματα για τον υπολογισμό του pH
1. Πρώτος ιονισμός: Το πρώτο πρωτόνιο ιονίζει εντελώς:
H₂so₄ (aq) → h⁺ (aq) + hso₄⁻ (aq)
Αυτό παράγει 1 mole ιόντων Η ίδων ανά γραμμομόριο H₂so₄.
2. Δεύτερος ιονισμός: Το ιόν θειικού υδρογόνου (HSO₄⁻) ιονίζει επίσης, αλλά σε μικρότερο βαθμό:
Hso₄⁻ (aq) ⇌ h⁺ (aq) + so₄²⁻ (aq)
Ο δεύτερος ιονισμός δεν είναι πλήρης, αλλά εξακολουθεί να συμβάλλει ορισμένα ιόντα Η.
3. Συνολική συγκέντρωση H⁺: Δεδομένου ότι ο δεύτερος ιονισμός δεν είναι πλήρης, η πραγματική συγκέντρωση ιόντων Η ίδων στο διάλυμα θα είναι ελαφρώς υψηλότερη από 1 Μ.
4. Για να υπολογίσετε το ακριβές pH, θα χρειαστείτε τη σταθερά ισορροπίας (KA) για τον δεύτερο ιονισμό θειικού οξέος. Ωστόσο, για μια ακατάλληλη εκτίμηση, μπορούμε να υποθέσουμε ότι ο δεύτερος ιονισμός είναι αμελητέος.
κατά προσέγγιση ph:
* Υποθέτοντας ότι μόνο ο πρώτος ιονισμός συμβάλλει σημαντικά στη συγκέντρωση Η, έχουμε [H⁺] ≈ 1 M.
* ph =-log [h⁺] =-log (1) = 0
Σημαντική σημείωση: Το πραγματικό pH του θειικού οξέος 1 Μ θα είναι ελαφρώς χαμηλότερο από 0 (πιο όξινο) λόγω του δεύτερου ιονισμού, αλλά θα είναι πολύ κοντά στο 0.