Ορισμός και ιδιότητες μεταλλικής συγκόλλησης
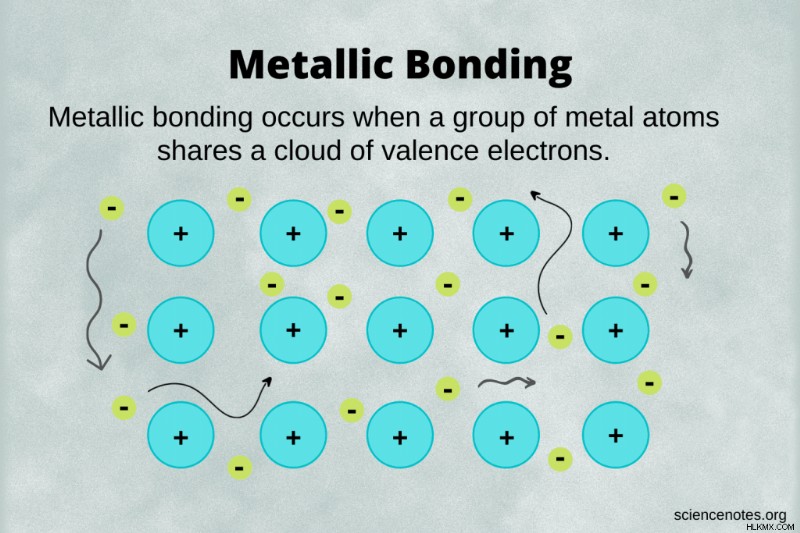
Μεταλλική συγκόλληση είναι ένας τύπος χημικού δεσμού όπου οι μεταλλικοί πυρήνες μοιράζονται ηλεκτρόνια ελεύθερου σθένους. Αυτά τα ελεύθερα ηλεκτρόνια ονομάζονται μετατοποθετημένα επειδή δεν περιορίζονται (τοποθετούνται) σε ένα άτομο. Αντίθετα, τα ηλεκτρόνια σθένους μοιράζονται μεταξύ δύο ατόμων σε έναν ομοιοπολικό δεσμό και περνούν περισσότερο χρόνο κοντά στο ένα άτομο από το άλλο σε έναν ιοντικό δεσμό.
- Στους μεταλλικούς δεσμούς, τα ηλεκτρόνια σθένους αποεντοπίζονται ή ελεύθερα να ρέουν μεταξύ πολλών ατόμων.
- Οι ιοντικοί και ομοιοπολικοί δεσμοί περιλαμβάνουν μόνο δύο άτομα.
- Η μεταλλική συγκόλληση ευθύνεται για πολλές από τις βασικές ιδιότητες των μετάλλων.
Το μοντέλο της Electron Sea
Το μοντέλο της θάλασσας ηλεκτρονίων είναι μια απλοϊκή και κάπως ανακριβής άποψη της μεταλλικής σύνδεσης, αλλά είναι η πιο εύκολη οπτική. Σε αυτό το μοντέλο, μια θάλασσα ηλεκτρονίων επιπλέει γύρω από ένα πλέγμα μεταλλικών κατιόντων.
Το κύριο πρόβλημα με αυτό το μοντέλο είναι ότι τα άτομα μετάλλου ή μεταλλοειδών δεν είναι, στην πραγματικότητα, ιόντα. Εάν έχετε ένα κομμάτι μετάλλου νατρίου, για παράδειγμα, αυτό αποτελείται από άτομα Na και όχι ιόντα Na. Τα ηλεκτρόνια δεν επιπλέουν τυχαία γύρω από τον πυρήνα. Αντίθετα, το ηλεκτρόνιο που γεμίζει τη διαμόρφωση ηλεκτρονίων ενός ατόμου προέρχεται από αυτό το άτομο ή έναν από τους γείτονές του. Σε ορισμένες περιπτώσεις, τα ηλεκτρόνια επιπλέουν γύρω από συστάδες πυρήνων. Μοιάζει πολύ με δομές συντονισμού σε ομοιοπολικούς δεσμούς.
Πώς σχηματίζονται οι μεταλλικοί δεσμοί
Όπως οι ομοιοπολικοί δεσμοί, έτσι και οι μεταλλικοί δεσμοί σχηματίζονται μεταξύ δύο ατόμων με παρόμοιες τιμές ηλεκτραρνητικότητας. Τα άτομα που σχηματίζουν μεταλλικούς δεσμούς είναι μέταλλα και μερικά μεταλλοειδή. Για παράδειγμα, οι μεταλλικοί δεσμοί εμφανίζονται σε ασήμι, χρυσό, ορείχαλκο και μπρούτζο. Είναι επίσης ο τύπος σύνδεσης στο υδρογόνο υπό πίεση και στο αλλοτρόπο άνθρακα γραφένιο.
Αυτό που κάνει τους μεταλλικούς δεσμούς να λειτουργούν είναι ότι τα τροχιακά ηλεκτρονίων σθένους που σχετίζονται με τους θετικά φορτισμένους πυρήνες επικαλύπτονται το ένα το άλλο. Στις περισσότερες περιπτώσεις, αυτό περιλαμβάνει s και p τροχιακά. Τα άτομα μετάλλου συνδέονται μεταξύ τους με έλξη μεταξύ των θετικών πυρήνων και των αποτοποθετημένων ηλεκτρονίων.
Δεσμοί που σχηματίζονται από μέταλλα
Τα άτομα μετάλλου σχηματίζουν ιοντικούς δεσμούς με αμέταλλα. Σχηματίζουν είτε ομοιοπολικούς είτε μεταλλικούς δεσμούς με τον εαυτό τους ή με άλλα μέταλλα. Το υδρογόνο και τα αλκαλιμέταλλα, ειδικότερα, σχηματίζουν ομοιοπολικούς και μεταλλικούς δεσμούς. Έτσι, εμφανίζεται μεταλλικό υδρογόνο και λίθιο. Το ίδιο και το H2 και Li2 μόρια αερίου.
Μεταλλικό δέσιμο στις ερωτήσεις για το σπίτι
Τύπος δεσμού που σχηματίστηκε
Η πιο κοινή ερώτηση για το σπίτι ρωτά εάν δύο άτομα σχηματίζουν μεταλλικούς, ιοντικούς ή ομοιοπολικούς δεσμούς. Τα άτομα σχηματίζουν μεταλλικούς δεσμούς όταν είναι και τα δύο μέταλλα. Μπορούν επίσης να σχηματίσουν ομοιοπολικούς δεσμούς σε ορισμένες περιπτώσεις, αλλά αν πρέπει να επιλέξετε έναν τύπο δεσμού, ακολουθήστε τον μεταλλικό. Σχηματίζονται ιονικοί δεσμοί μεταξύ ατόμων με πολύ διαφορετικές τιμές ηλεκτραρνητικότητας (συνήθως μεταξύ ενός μετάλλου και ενός μη μετάλλου). Οι ομοιοπολικοί δεσμοί σχηματίζονται συνήθως μεταξύ δύο μη μετάλλων.
Πρόβλεψη ιδιοτήτων
Μπορείτε να χρησιμοποιήσετε μεταλλική συγκόλληση για να συγκρίνετε τις ιδιότητες των μεταλλικών στοιχείων. Για παράδειγμα, ο μεταλλικός δεσμός εξηγεί γιατί το μαγνήσιο έχει υψηλότερο σημείο τήξης από το νάτριο. Το στοιχείο με υψηλότερο σημείο τήξης περιέχει ισχυρότερους χημικούς δεσμούς.
Προσδιορίστε ποιο στοιχείο σχηματίζει ισχυρότερους δεσμούς εξετάζοντας τις διαμορφώσεις ηλεκτρονίων των ατόμων:
Νάτριο:[Ne]3s
Μαγνήσιο:[Ne]3s
Το νάτριο έχει ένα ηλεκτρόνιο σθένους, ενώ το μαγνήσιο έχει δύο ηλεκτρόνια σθένους. Αυτά είναι τα ηλεκτρόνια που αποεντοπίζονται σε μεταλλικούς δεσμούς. Έτσι, η «θάλασσα» των ηλεκτρονίων γύρω από ένα άτομο μαγνησίου είναι διπλάσια από τη θάλασσα γύρω από ένα άτομο νατρίου.
Και στα δύο άτομα, τα ηλεκτρόνια σθένους ελέγχονται από τον ίδιο αριθμό κελυφών ηλεκτρονίων (τον πυρήνα [Ne] ή 1s 2s 2p). Κάθε άτομο μαγνησίου έχει ένα πρωτόνιο περισσότερο από ένα άτομο νατρίου, επομένως ο πυρήνας του μαγνησίου ασκεί ισχυρότερη ελκτική δύναμη στα ηλεκτρόνια σθένους.
Τέλος, το άτομο μαγνησίου είναι ελαφρώς μικρότερο από το άτομο νατρίου επειδή υπάρχει μεγαλύτερη ελκτική δύναμη μεταξύ του πυρήνα και των ηλεκτρονίων.
Συνδυάζοντας όλα αυτά τα στοιχεία, δεν αποτελεί έκπληξη ότι το μαγνήσιο σχηματίζει ισχυρότερους μεταλλικούς δεσμούς και έχει υψηλότερο σημείο τήξης από το νάτριο.
Μεταλλική συγκόλληση και μεταλλικές ιδιότητες
Η μεταλλική συγκόλληση ευθύνεται για πολλές από τις ιδιότητες που σχετίζονται με τα μέταλλα.
- Υψηλή ηλεκτρική και θερμική αγωγιμότητα :Τα ελεύθερα ηλεκτρόνια είναι φορείς φορτίου στην ηλεκτρική αγωγιμότητα και φορείς θερμικής ενέργειας (θερμότητας) στη θερμική αγωγιμότητα.
- Υψηλά σημεία τήξης και βρασμού :Οι ισχυρές ελκτικές δυνάμεις μεταξύ μη εντοπισμένων ηλεκτρονίων και ατομικών πυρήνων δίνουν στα μέταλλα υψηλά σημεία τήξης και βρασμού.
- Ελακτότητα και ολκιμότητα :Η μεταλλική συγκόλληση ευθύνεται για τις μηχανικές ιδιότητες του μετάλλου, συμπεριλαμβανομένης της ελαστότητας και της ολκιμότητας. Επειδή τα ηλεκτρόνια γλιστρούν το ένα δίπλα στο άλλο, είναι δυνατό να σφυρηλατηθούν τα μέταλλα σε φύλλα (ελατότητα) και να τα συρθούν σε σύρματα (ολκιμότητα).
- Μεταλλική λάμψη :Τα αποτοποθετημένα ηλεκτρόνια αντανακλούν το μεγαλύτερο μέρος του φωτός, δίνοντας στα μέταλλα μια γυαλιστερή εμφάνιση.
- Ασημί χρώμα :Τα περισσότερα μέταλλα φαίνονται ασήμι επειδή το περισσότερο φως αντανακλάται από τα ταλαντευόμενα ηλεκτρόνια συντονισμού (επιφανειακά πλασμόνια). Το απορροφούμενο φως τείνει να βρίσκεται στο υπεριώδες τμήμα του φάσματος, το οποίο βρίσκεται εκτός του ορατού εύρους. Σε χαλκό και χρυσό, το απορροφούμενο φως είναι εντός του ορατού εύρους, δίνοντας σε αυτά τα μέταλλα ένα κοκκινωπό και κιτρινωπό χρώμα.
Πόσο ισχυροί είναι οι μεταλλικοί δεσμοί;
Η μεταλλική συγκόλληση κυμαίνεται από πολύ ισχυρή έως αδύναμη. Η δύναμή του εξαρτάται σε μεγάλο βαθμό από το πόσα κελύφη ηλεκτρονίων προστατεύουν τα ηλεκτρόνια σθένους από την πυρηνική έλξη. Εν μέρει αυτό οφείλεται σε σχετικιστικά αποτελέσματα σε μεγάλα άτομα, επομένως ο μεταλλικός δεσμός στον υδράργυρο και τις λανθανίδες είναι ασθενέστερος από ότι στα ελαφρύτερα μέταλλα μετάπτωσης.
Υπάρχουν πάρα πολλές μεμονωμένες παραλλαγές για να γενικεύσουμε σχετικά με τη σχετική αντοχή των μεταλλικών, ιοντικών και ομοιοπολικών δεσμών.
Αναφορές
- Brewer, Scott H.; Franzen, Stefan (2002). «Εξάρτηση συχνότητας πλάσματος από οξείδιο του κασσιτέρου ινδίου από την αντίσταση του φύλλου και τα επιφανειακά επιστρώματα που προσδιορίζονται με φασματοσκοπία ανάκλασης FTIR». The Journal of Physical Chemistry B . 106 (50):12986–12992. doi:10.1021/jp026600x
- Daw, Murray S.; Foiles, Stephen M.; Baskes, Michael I. (1993). «Η μέθοδος του ενσωματωμένου ατόμου:μια ανασκόπηση της θεωρίας και των εφαρμογών». Αναφορές Επιστήμης Υλικών . 9 (7–8):251–310. doi:10.1016/0920-2307(93)90001-U
- Okumura, Κ. &Templeton, Ι. Μ. (1965). «Η επιφάνεια Fermi του Καισίου». Πρακτικά της Βασιλικής Εταιρείας του Λονδίνου A . 287 (1408):89–104. doi:10.1098/rspa.1965.0170
- Pauling, Linus (1960). Η φύση του χημικού δεσμού . Cornell University Press. ISBN 978-0-8014-0333-0.
- Rioux, F. (2001). «Ο ομοιοπολικός δεσμός στο H2 ". Ο Χημικός Εκπαιδευτής . 6 (5):288–290. doi:10.1007/s00897010509a




