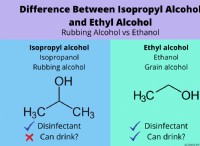
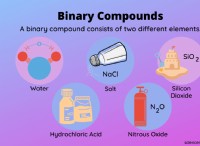
Τι θα χαλαρώσει ή θα κερδίσει το χλώριο όταν σχηματίζει ένα ιόν;
* Διαμόρφωση ηλεκτρονίων: Το χλώριο έχει 17 ηλεκτρόνια, με τη διαμόρφωση 2-8-7. Αυτό σημαίνει ότι έχει 7 ηλεκτρόνια στο εξώτατο κέλυφος (κέλυφος σθένους).
* Κανόνας οκτάδων: Τα άτομα προσπαθούν να επιτύχουν μια σταθερή διαμόρφωση ηλεκτρονίων όπως τα ευγενή αέρια, τα οποία έχουν 8 ηλεκτρόνια στο εξώτατο κέλυφος τους (εκτός από το ήλιο, το οποίο έχει 2).
* Ιονική σύνδεση: Το χλώριο είναι εξαιρετικά ηλεκτροαρνητικό, που σημαίνει ότι έχει ισχυρή έλξη για τα ηλεκτρόνια. Για να επιτύχει ένα σταθερό οκτάτο, κερδίζει εύκολα ένα ηλεκτρόνιο για να γίνει ένα αρνητικά φορτισμένο ιόν (ανιόν).
Επομένως, όταν το χλώριο σχηματίζει ένα ιόν, κερδίζει ένα ηλεκτρόνιο και γίνεται CL⁻ (ιόν χλωριούχου).