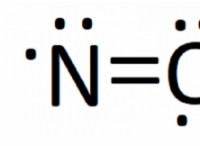Γιατί το 1-χλωροεξάνιο έχει υψηλότερο σημείο βρασμού από 1-ιωδοεξάνιο;
Van der Waals Δυνάμεις και Polarizability
* Van der Waals Δυνάμεις: Αυτά είναι αδύναμα διαμοριακά αξιοθέατα που προκύπτουν από προσωρινές διακυμάνσεις στην κατανομή ηλεκτρονίων. Όσο ισχυρότερη είναι οι δυνάμεις van der Waals, τόσο περισσότερη ενέργεια απαιτείται για να τους ξεπεράσουμε και να προκαλέσει μια ουσία να βράσει.
* Polarizability: Η ευκολία με την οποία το σύννεφο ηλεκτρονίων ενός ατόμου μπορεί να παραμορφωθεί από ένα εξωτερικό ηλεκτρικό πεδίο. Τα μεγαλύτερα άτομα είναι πιο πολωμένα.
Πώς ισχύει για το 1-χλωροεξάνιο και το 1-ιωδοεξάνιο:
1. Μέγεθος: Το ιώδιο είναι σημαντικά μεγαλύτερο από το χλώριο. Αυτό σημαίνει ότι το σύννεφο ηλεκτρονίων του ιωδίου είναι πιο απλωμένο, καθιστώντας το πιο πολωμένο.
2. Η αυξημένη πολωσιμότητα του ιωδίου οδηγεί σε ισχυρότερα προσωρινά διπόλια και ισχυρότερες δυνάμεις διασποράς του Λονδίνου (ένας τύπος δύναμης van der Waals) μεταξύ μορίων 1-ιωδοεξανίου.
3. σημείο βρασμού: Οι ισχυρότερες δυνάμεις van der Waals στο 1-Iodohexane απαιτούν περισσότερη ενέργεια για να ξεπεραστεί, με αποτέλεσμα ένα χαμηλότερο σημείο βρασμού σε σύγκριση με 1-χλωροεξάνιο.
Συνοπτικά:
Ενώ το ιώδιο είναι βαρύτερο, η μεγαλύτερη πολωσιμότητά του έχει ως αποτέλεσμα ισχυρότερα διαμοριακά αξιοθέατα, τα οποία τελικά οδηγούν σε χαμηλότερο σημείο βρασμού για 1-ιωδοεξάνιο.