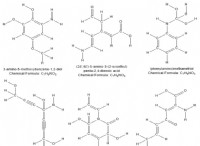
Πώς διαφέρουν τα ιόντα και τα πολυατομικά ιόν;
ιόντα
* Ορισμός: Άτομα ή ομάδες ατόμων που έχουν κερδίσει ή χαμένα ηλεκτρόνια, με αποτέλεσμα ένα καθαρό ηλεκτρικό φορτίο.
* Τύποι:
* ΚΟΟΔΙΑ: Τα θετικά φορτισμένα ιόντα που σχηματίζονται από την απώλεια ηλεκτρονίων (π.χ., Na⁺, Ca²⁺)
* Anions: Αρνητικά φορτισμένα ιόντα που σχηματίζονται από την απόκτηση ηλεκτρονίων (π.χ., CL⁻, o²⁻)
* Παραδείγματα: Ιόν νατρίου (Na⁺), ιόν χλωριούχου (CL⁻), ιόν μαγνησίου (mg²⁺)
Πολυατομικά ιόντα
* Ορισμός: Ομάδες δύο ή περισσότερων ατόμων που συνδέονται ομοιοπολικά και φέρουν καθαρό ηλεκτρικό φορτίο.
* Χαρακτηριστικά:
* Λειτουργεί ως ενιαία μονάδα σε χημικές αντιδράσεις.
* Έχετε ένα συγκεκριμένο φορτίο που καθορίζεται από τον αριθμό των ηλεκτρονίων που χάνονται ή αποκτήθηκαν από την ομάδα.
* Παραδείγματα:
* Υδροξείδιο: Ωχ.
* νιτρικά: Όχι ₃⁻
* θειικό: SO₄²⁻
* αμμώνιο: Nh₄⁺
* Φωσφορικό: Po₄³⁻
Βασικές διαφορές
| Χαρακτηριστικό | Ιόντα | Πολυατομικά ιόντα |
| --- | --- | --- |
| Σύνθεση | Ενιαίο άτομο | Ομάδα ατόμων |
| δεσμός | Δεν υπάρχουν ομοιοπολικοί δεσμοί στο ιόν | Ομοιοπολικοί δεσμοί εντός του ιόντος |
| χρέωση | Καθορίζεται από απώλεια ηλεκτρονίων ή κέρδος | Καθορίζεται από το συνολικό φορτίο της ομάδας |
| Παραδείγματα | Na⁺, cl⁻, mg² | Ωχ, όχι, so₄²⁻, nh₄⁺ |
Πώς σχετίζονται:
* Τα πολυατομικά ιόντα είναι ένας συγκεκριμένος τύπος ιόντων.
* Τα πολυατομικά ιόντα συμπεριφέρονται ως μία μόνο φορτισμένη μονάδα σε χημικές αντιδράσεις, ακριβώς όπως τα απλά ιόντα.
Συνοπτικά:
Η βασική διαφορά έγκειται στη δομή . Τα ιόντα είναι μεμονωμένα άτομα με χρέωση, ενώ τα πολυατομικά ιόντα είναι ομάδες ατόμων που συνδέονται μαζί και φέρουν χρέωση.