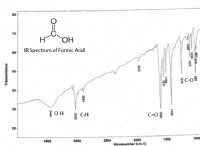
Ποια είναι η δομή του Lewis dot για το ξίδι;
1.
* Carbon (C):4 ηλεκτρόνια σθένους x 2 =8
* Υδρογόνο (Η):1 Electron Valence X 4 =4
* Οξυγόνο (o):6 ηλεκτρόνια σθένους x 2 =12
* Συνολικά ηλεκτρόνια σθένους =8 + 4 + 12 =24
2. Προσδιορίστε το κεντρικό άτομο:
* Ο άνθρακας είναι το λιγότερο ηλεκτροαρνητικό άτομο και σχηματίζει τη σπονδυλική στήλη του μορίου.
3. Συνδεθείτε άτομα με μεμονωμένους δεσμούς:
* Συνδέστε τους δύο άνθρακες με έναν μόνο δεσμό.
* Συνδέστε κάθε άνθρακα σε τρία υδρογόνα.
* Συνδέστε έναν άνθρακα σε ένα οξυγόνο με διπλό δεσμό (C =O).
* Συνδέστε τον άλλο άνθρακα σε ένα οξυγόνο με έναν μόνο δεσμό (C-O).
* Συνδέστε το οξυγόνο με έναν μόνο δεσμό με ένα υδρογόνο (O-H).
4. Ολοκληρώστε οκτάδες:
* Διανείμετε τα υπόλοιπα ηλεκτρόνια ως ζεύγη μοναχικών γύρω από τα άτομα οξυγόνου για να ολοκληρώσουν τις οκτάδες τους.
δομή Lewis dot του οξικού οξέος (ch₃cooh):
`` `
HO
\ //
C-C
/ \
H h
|
Ο
||
H
`` `
Επεξήγηση:
* Κάθε άτομο άνθρακα μοιράζεται τα τέσσερα ηλεκτρόνια σθένους για να σχηματίσει τέσσερα ομόλογα.
* Κάθε άτομο υδρογόνου μοιράζεται το ηλεκτρόνιο ενός σθένους για να σχηματίσει έναν μόνο δεσμό.
* Κάθε άτομο οξυγόνου έχει δύο μοναχικά ζεύγη ηλεκτρονίων για να ολοκληρώσει το οκτάδες του.
Σημαντική σημείωση:
* Η δομή του Lewis Dot είναι μια απλοποιημένη αναπαράσταση και δεν δείχνει την πραγματική δομή 3D του μορίου.
* Το οξικό οξύ μπορεί να σχηματίσει δεσμούς υδρογόνου λόγω της παρουσίας της καρβοξυλικής ομάδας (COOH).
* Η όξινη φύση του ξιδιού προέρχεται από το ιόν υδρογόνου (Η+) που μπορεί να διαχωριστεί από την καρβοξυλική ομάδα.