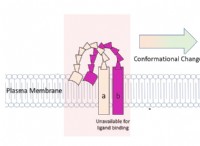
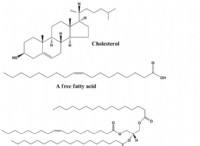
Τι κοινό έχουν οι ομοιοπολικοί δεσμοί και οι πολικές;
* ομοιοπολικοί δεσμοί: Αυτά σχηματίζονται όταν δύο άτομα μοιράζονται ηλεκτρόνια.
* πολικότητα: Αυτό αναφέρεται στην ανομοιογενή κατανομή της πυκνότητας ηλεκτρονίων μέσα σε ένα μόριο. Αυτό σημαίνει ότι το ένα άκρο του μορίου έχει ένα ελαφρώς θετικό φορτίο (δ+) και το άλλο άκρο έχει ελαφρώς αρνητικό φορτίο (δ-).
Η σύνδεση:
* πολικοί ομοιοπολικοί δεσμοί: Η πολικότητα εμφανίζεται συχνά μέσα σε ένας ομοιοπολικός δεσμός. Αυτό συμβαίνει όταν τα άτομα που εμπλέκονται στον δεσμό έχουν διαφορετικές ηλεκτροηλεκτρικές ικανότητες. Η ηλεκτροαρνητικότητα είναι η ικανότητα ενός ατόμου να προσελκύει ηλεκτρόνια.
* Το άτομο με υψηλότερη ηλεκτροαρνητικότητα θα τραβήξει τα κοινόχρηστα ηλεκτρόνια πιο κοντά στον εαυτό του, δημιουργώντας ένα μερικό αρνητικό φορτίο σε αυτό το άτομο και ένα μερικό θετικό φορτίο στο άλλο άτομο.
* Για παράδειγμα, σε ένα μόριο νερού (H₂O), το οξυγόνο είναι περισσότερο ηλεκτροαρνητικό από το υδρογόνο. Αυτό έχει ως αποτέλεσμα έναν πολικό ομοιοπολικό δεσμό, με το άτομο οξυγόνου να έχει μερικό αρνητικό φορτίο και τα άτομα υδρογόνου να έχουν μερική θετική φορτία.
Βασικό σημείο:
* Δεν είναι όλοι ομοιοπολικοί δεσμοί πολικοί. Όταν δύο πανομοιότυπα δεσμούς ατόμων (π.χ., σε ένα μόριο υδρογόνου, H₂), η διαφορά ηλεκτροαρνητικότητας είναι μηδενική, οπότε ο δεσμός είναι μη πολικός.
Συνοπτικά: Η πολικότητα είναι μια ιδιότητα που μπορεί να προκύψει από τη φύση των ομοιοπολικών δεσμών, ιδιαίτερα όταν τα άτομα που εμπλέκονται στον δεσμό έχουν διαφορετικές ηλεκτροθεραπευτικές περιοχές.