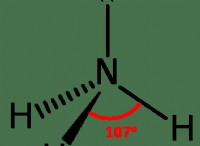
Τι είναι μέση με την ευελιξία μιας ουσίας;
Εδώ είναι μια κατανομή:
Βασικές έννοιες:
* Διάλυση: Η διαδικασία όπου μια ουσία (διαλυμένη ουσία) διασπάται σε μεμονωμένα μόρια ή ιόντα και διασκορπίζεται ομοιόμορφα σε μια άλλη ουσία (διαλύτης).
* Διαλυμένη ουσία: Η ουσία που διαλύεται στον διαλύτη.
* διαλύτης: Η ουσία που διαλύει τη διαλυμένη ουσία.
* Λύση: Το ομοιογενές μίγμα που σχηματίζεται όταν η ουσία διαλύεται στον διαλύτη.
Διαλυτότητα:
* Ποσοτική: Η διαλυτότητα εκφράζεται συχνά ως η μέγιστη ποσότητα διαλυμένης ουσίας Αυτό μπορεί να διαλυθεί σε μια δεδομένη ποσότητα διαλύτη σε συγκεκριμένη θερμοκρασία και πίεση. Αυτό συνήθως εκφράζεται ως γραμμάρια διαλελυμένης ουσίας ανά 100 γραμμάρια διαλύτη.
* ποιοτικό: Μπορείτε επίσης να περιγράψετε τη διαλυτότητα ως "διαλυτό" (διαλύεται εύκολα), "αδιάλυτο" (δεν διαλύεται) ή "μερικώς διαλυτό" (διαλύεται σε κάποιο βαθμό).
Παράγοντες που επηρεάζουν τη διαλυτότητα:
* Θερμοκρασία: Η διαλυτότητα συνήθως αυξάνεται με θερμοκρασία για στερεά και υγρά, αλλά μειώνεται για τα αέρια.
* Πίεση: Η πίεση έχει σημαντική επίδραση στη διαλυτότητα των αερίων, αλλά όχι τόσο στα στερεά ή τα υγρά.
* Φύση της διαλυμένης ουσίας και του διαλύτη: "Όπως διαλύεται." Οι πολικές διαλυμένες ουσίες διαλύονται σε πολικούς διαλύτες (π.χ. ζάχαρη σε νερό), ενώ οι μη πολικές διαλυμένες διαλυμένες διαλύσεις διαλύονται σε μη πολικούς διαλύτες (π.χ. πετρέλαιο σε βενζίνη).
Παραδείγματα:
* ζάχαρη στο νερό: Η ζάχαρη είναι διαλυτή στο νερό επειδή και τα δύο είναι πολικά μόρια.
* αλάτι στο νερό: Το αλάτι (NaCl) είναι διαλυτό στο νερό επειδή διαχωρίζεται σε ιόντα (Na+ και Cl-) που αλληλεπιδρούν με τα πολικά μόρια νερού.
* Λάδι στο νερό: Το λάδι είναι αδιάλυτο στο νερό επειδή το λάδι είναι μη πολικό και το νερό είναι πολικό.
Συνοπτικά, η διαλυτότητα είναι ένα μέτρο για το πόσο μια ουσία μπορεί να διαλυθεί σε ένα δεδομένο διαλύτη υπό συγκεκριμένες συνθήκες. Είναι μια βασική ιδέα στη χημεία και σε πολλούς άλλους τομείς, συμπεριλαμβανομένης της ιατρικής, της βιολογίας και της περιβαλλοντικής επιστήμης.