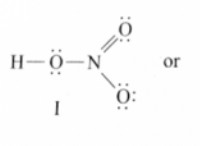
Ένα χαρακτηριστικό των περισσότερων μη μεταλλικών στερεών είναι ότι είναι;
Εδώ είναι γιατί:
* Μη μεταλλικά στερεά γενικά συγκρατούνται από ομοιοπολικά δεσμούς . Αυτοί οι δεσμοί είναι ισχυροί μέσα στο μόριο αλλά αδύναμοι μεταξύ των μορίων.
* Βρετανία σημαίνει ότι το υλικό σπάει εύκολα κάτω από το άγχος. Επειδή οι δεσμοί μεταξύ των μορίων σε μη μεταλλικά στερεά είναι αδύναμοι, όταν εφαρμόζεται το άγχος, αυτοί οι δεσμοί σπάνε εύκολα, οδηγώντας σε κάταγμα.
Ας το συγκρίνουμε με τα μέταλλα:
* Μεταλλικά στερεά κρατούνται μαζί από μια Sea of Electrons . Αυτό επιτρέπει στα άτομα να γλιστρούν ο ένας τον άλλον εύκολα, καθιστώντας τα όλκιμο (ικανός να τεντωθεί) και εύπλαστο (ικανός να διαμορφωθεί).
Παραδείγματα εύθραυστων μη μεταλλικών στερεών:
* Γυαλί
* Διαμάντι
* Θείο
* Πλαστικό
* Rock Salt
Εξαιρέσεις:
Ενώ τα περισσότερα μη μεταλλικά στερεά είναι εύθραυστα, υπάρχουν εξαιρέσεις. Ο γραφίτης, για παράδειγμα, είναι ένα μη μέταλλο που είναι μαλακό και ολισθηρό λόγω της στρωμένης δομής του.