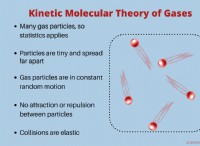
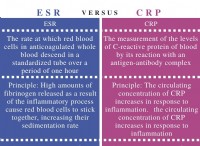
Εξηγήστε το ρόλο των ηλεκτρονίων στη χημική σύνδεση και τη σχέση με τον κανόνα οκτάδων;
ηλεκτρόνια:Η κόλλα της χημικής σύνδεσης
Τα ηλεκτρόνια είναι οι βασικοί παράγοντες της χημικής σύνδεσης. Εδώ είναι:
1. ηλεκτρόνια σθένους: Τα εξώτατα ηλεκτρόνια σε ένα άτομο, που ονομάζεται Electrons , είναι αυτοί που εμπλέκονται στη συγκόλληση. Καθορίζουν την αντιδραστικότητα ενός ατόμου και τον τρόπο αλληλεπίδρασης με άλλα άτομα.
2. έλξη και σταθερότητα: Ο δεσμός των ατόμων για την επίτευξη μιας πιο σταθερής διαμόρφωσης ηλεκτρονίων. Αυτό συνήθως σημαίνει να έχετε ένα πλήρες εξωτερικό κέλυφος ηλεκτρονίων, που συχνά μοιάζει με τη διαμόρφωση του ευγενούς αερίου με οκτώ ηλεκτρόνια σθένους (ο κανόνας octet ).
3. Τύποι ομολόγων:
* Ιονικά ομόλογα: Τα ηλεκτρόνια μεταφέρονται από ένα άτομο σε άλλο. Αυτό δημιουργεί θετικά φορτισμένα ιόντα (κατιόντα) και αρνητικά φορτισμένα ιόντα (ανιόντα) που προσελκύονται μεταξύ τους λόγω ηλεκτροστατικών δυνάμεων.
* ομοιοπολικοί δεσμοί: Τα ηλεκτρόνια μοιράζονται μεταξύ δύο ατόμων. Αυτά τα κοινά ηλεκτρόνια προσελκύονται από τους πυρήνες και των δύο ατόμων, κρατώντας τα μαζί. Οι ομοιοπολικοί δεσμοί μπορεί να είναι ενιαίοι, διπλοί ή τριπλοί ανάλογα με τον αριθμό των κοινόχρηστων ηλεκτρονίων.
4.
* Ο κανόνας οκτάδων δηλώνει ότι τα άτομα τείνουν να κερδίζουν, να χάνουν ή να μοιράζονται ηλεκτρόνια για να επιτύχουν μια σταθερή διαμόρφωση με οκτώ ηλεκτρόνια στο εξώτατο κέλυφος τους.
* Αυτός ο κανόνας είναι μια χρήσιμη κατευθυντήρια γραμμή, αλλά υπάρχουν εξαιρέσεις, ειδικά για τα άτομα στην πρώτη και τη δεύτερη σειρά του περιοδικού πίνακα.
Παράδειγμα:
* νάτριο (Na) και χλώριο (CL): Το νάτριο έχει ένα ηλεκτρόνιο σθένους και το χλώριο έχει επτά. Το νάτριο χάνει το ηλεκτρόνιο του για να γίνει ένα θετικό ιόν (Na+), ενώ τα κέρδη χλωρίου που το ηλεκτρόνιο θα γίνει αρνητικό ιόν (Cl-). Η ηλεκτροστατική έλξη μεταξύ Na+ και Cl-σχηματίζει έναν ιοντικό δεσμό.
* υδρογόνο (Η) και οξυγόνο (o): Το υδρογόνο έχει ένα ηλεκτρόνιο σθένους και το οξυγόνο έχει έξι. Μοιράζονται ηλεκτρόνια για να σχηματίσουν έναν ομοιοπολικό δεσμό στο νερό (H2O). Κάθε άτομο υδρογόνου μοιράζεται το ηλεκτρόνιο του με οξυγόνο και το οξυγόνο μοιράζεται δύο από τα ηλεκτρόνια του με τα άτομα υδρογόνου.
Συνοπτικά: Τα ηλεκτρόνια είναι η κινητήρια δύναμη πίσω από τη χημική σύνδεση. Η κίνηση τους, η κοινή χρήση και η μεταφορά τους οδηγούν στο σχηματισμό σταθερών μορίων και ενώσεων. Ο κανόνας οκτάδων παρέχει ένα χρήσιμο πλαίσιο για την κατανόηση του τρόπου με τον οποίο τα άτομα προσπαθούν να επιτύχουν μια σταθερή διαμόρφωση ηλεκτρονίων μέσω της σύνδεσης.