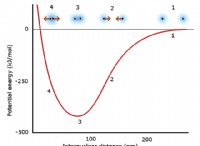
Τι αυξάνει την ικανότητα διαλύτες να διαλύσει τη διαλυτή ουσία;
1. Θερμοκρασία:
* Για τα περισσότερα στερεά και υγρά: Η αύξηση της θερμοκρασίας γενικά αυξάνει τη διαλυτότητα. Αυτό οφείλεται στο γεγονός ότι η θερμότητα παρέχει περισσότερη ενέργεια στα μόρια του διαλύτη, επιτρέποντάς τους να σπάσουν τα μόρια διαλυμένης ουσίας πιο αποτελεσματικά.
* για αέρια: Η αύξηση της θερμοκρασίας μειώνει τη διαλυτότητα. Αυτό οφείλεται στο γεγονός ότι οι υψηλότερες θερμοκρασίες προκαλούν την ταχύτερη μετακίνηση των μορίων αερίου και να ξεφύγουν από την υγρή φάση πιο εύκολα.
2. Πολικότητα:
* όπως διαλύεται όπως: Οι πολικοί διαλύτες (όπως το νερό) διαλύουν τις πολικές διαλύσεις (όπως τα άλατα), ενώ οι μη πολικοί διαλύτες (όπως το πετρέλαιο) διαλύουν μη πολικές διαλυμένες ουσίες (όπως τα λίπη).
* Αναμψιά: Οι διαλύτες που μπορούν να αναμειγνύονται σε οποιαδήποτε αναλογία ονομάζονται αναμίξιμο. Για παράδειγμα, το νερό και η αιθανόλη είναι αναμίξιμα.
3. Πίεση:
* για στερεά και υγρά: Η πίεση έχει αμελητέα επίδραση στη διαλυτότητα.
* για αέρια: Η αύξηση της πίεσης αυξάνει τη διαλυτότητα. Αυτό οφείλεται στο γεγονός ότι η υψηλότερη πίεση αναγκάζει περισσότερα μόρια αερίου σε διάλυμα.
4. Επιφάνεια της ουσίας:
* Μικρότερο μέγεθος σωματιδίων: Μια μεγαλύτερη επιφάνεια της διαλελυμένης ουσίας επιτρέπει μεγαλύτερη αλληλεπίδραση με τα μόρια του διαλύτη, οδηγώντας σε ταχύτερη διάλυση. Σκεφτείτε πώς ένας κύβος ζάχαρης διαλύεται πιο αργά από τη κοκκοποιημένη ζάχαρη.
5. Ταξινόμηση:
* ανάδευση ή ανακίνηση: Αυτό βοηθά στην επαφή με τα φρέσκα μόρια διαλύτη σε επαφή με τη διαλυμένη ουσία, αυξάνοντας τον ρυθμό διάλυσης.
6. Παρουσία άλλων διαλυτών:
* Κοινό αποτέλεσμα ιόντων: Η διαλυτότητα μιας φρικιαστικά διαλυτής ιοντικής ένωσης μπορεί να μειωθεί με την προσθήκη ενός διαλυτού άλατος που περιέχει ένα κοινό ιόν.
7. Χημικές αντιδράσεις:
* Αντιδράσεις βάσης οξέος: Ορισμένες διαλυμένες ουσίες διαλύονται λόγω χημικών αντιδράσεων με τον διαλύτη. Για παράδειγμα, πολλά μέταλλα διαλύονται σε οξέα επειδή αντιδρούν με το οξύ για να σχηματίσουν ιόντα.
Είναι σημαντικό να σημειωθεί ότι η διαλυτότητα μιας ουσίας είναι μια ιδιότητα που είναι ειδική για αυτή την ουσία και τον διαλύτη. Ενώ οι παράγοντες που αναφέρονται παραπάνω μπορούν να επηρεάσουν τη διαλυτότητα, ο βαθμός στον οποίο το κάνουν αυτό θα διαφέρει ανάλογα με τη συγκεκριμένη διαλυτή ουσία και τον διαλύτη.