Τι είναι η διαλυτότητα και η διάσπαση στο νερό;
Διαλυτότητα και διάσπαση στο νερό
Διαλυτότητα και διάσπαση είναι στενά συνδεδεμένες έννοιες που περιγράφουν πώς συμπεριφέρονται οι ουσίες όταν προστίθενται στο νερό.
Διαλυτότητα αναφέρεται στη μέγιστη ποσότητα μιας ουσίας που μπορεί να διαλύεται σε μια δεδομένη ποσότητα διαλύτη σε συγκεκριμένη θερμοκρασία . Η διαλυτότητα μιας ουσίας εξαρτάται από διάφορους παράγοντες, συμπεριλαμβανομένης της φύσης της διαλελυμένης ουσίας και του διαλύτη, της θερμοκρασίας και της πίεσης.
διάσταση αναφέρεται στη διαδικασία με την οποία μια ένωση διασπάται σε μικρότερα ιόντα ή μόρια όταν διαλύεται σε διαλύτη . Αυτό συμβαίνει κυρίως με ιοντικές ενώσεις και μερικές πολικές ομοιοπολικές ενώσεις.
Ακολουθεί μια κατανομή κάθε έννοιας:
Διαλυτότητα:
* Τι είναι: Η ικανότητα μιας ουσίας να διαλύεται σε έναν διαλύτη.
* Πώς μετράται: Η μέγιστη ποσότητα διαλυμένης ουσίας που μπορεί να διαλυθεί σε μια δεδομένη ποσότητα διαλύτη σε συγκεκριμένη θερμοκρασία. Αυτό συχνά εκφράζεται σε μονάδες όπως γραμμάρια ανά λίτρο (G/L) ή moles ανά λίτρο (mol/L).
* Παραδείγματα: Η ζάχαρη είναι διαλυτή στο νερό, ενώ η άμμος δεν είναι.
Διάσπαση:
* Τι είναι: Η διαδικασία μιας ένωσης που διασπάται σε ιόντα όταν διαλύεται σε έναν διαλύτη.
* Πώς λειτουργεί: Όταν οι ιοντικές ενώσεις διαλύονται στο νερό, τα πολικά μόρια νερού περιβάλλουν τα ιόντα, εξασθενίζοντας τις ηλεκτροστατικές δυνάμεις που συγκρατούν τα ιόντα. Αυτό επιτρέπει στα ιόντα να διαχωρίζονται και να κινούνται ελεύθερα σε διάλυμα.
* Παραδείγματα:
* Το χλωριούχο νάτριο (NaCl) διαχωρίζεται σε ιόντα νατρίου (Na+) και χλωριούχου (Cl-) όταν διαλύεται σε νερό.
* Το οξικό οξύ (CH3COOH) διαχωρίζεται εν μέρει σε ιόντα υδρογόνου (Η+) και ιόντα οξικού (CH3COO-) στο νερό.
Σχέση μεταξύ διαλυτότητας και αποσύνδεσης:
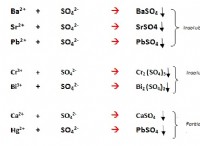
* Η διάσπαση είναι ένας βασικός παράγοντας που επηρεάζει τη διαλυτότητα: Για ιοντικές ενώσεις, η ικανότητα διαχωρισμού στο νερό συνδέεται άμεσα με τη διαλυτότητα τους. Όσο πιο εύκολα διαχωρίζεται μια ιοντική ένωση, τόσο πιο διαλυτή είναι.
* Δεν διαχωρίζονται όλες οι διαλυτές ουσίες: Ορισμένες ομοιοπολικές ενώσεις, όπως η ζάχαρη, διαλύονται στο νερό χωρίς να διαχωρίζονται σε ιόντα. Δημιουργούν λύσεις όπου τα μόρια παραμένουν άθικτα.
Συνοπτικά:
* Διαλυτότητα είναι η μέγιστη ποσότητα μιας ουσίας που μπορεί να διαλύσει σε έναν διαλύτη.
* διάσπαση είναι η διαδικασία μιας ένωσης που διασπάται σε ιόντα όταν διαλύεται.
* Η διάσπαση διαδραματίζει κρίσιμο ρόλο στη διαλυτότητα των ιοντικών ενώσεων.
Αυτές οι έννοιες είναι απαραίτητες για την κατανόηση πολλών χημικών διεργασιών, συμπεριλαμβανομένων των αντιδράσεων, της αγωγιμότητας και των ιδιοτήτων των λύσεων.