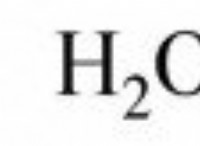Υπάρχει χημική διαφορά μεταξύ του gauseos και της υγρής κατάστασης της ίδιας ουσίας;
Αέρια κατάσταση:
* αδύναμες διαμοριακές δυνάμεις: Τα μόρια αερίου έχουν πολύ αδύναμες ελκυστικές δυνάμεις μεταξύ τους.
* Υψηλή κινητική ενέργεια: Τα μόρια αερίου κινούνται γρήγορα και τυχαία προς όλες τις κατευθύνσεις.
* Μεγάλες διαμοριακές αποστάσεις: Τα μόρια αερίου είναι πολύ μακριά, καταλαμβάνοντας μεγάλο όγκο.
* Συμπιέστης: Τα αέρια είναι εύκολα συμπιεσμένα επειδή υπάρχει πολύ κενός χώρος μεταξύ των μορίων.
* Δεν υπάρχει σταθερό σχήμα ή ένταση: Τα αέρια παίρνουν το σχήμα και τον όγκο του δοχείου τους.
υγρή κατάσταση:
* ισχυρότερες διαμοριακές δυνάμεις: Τα υγρά μόρια έχουν ισχυρότερες ελκυστικές δυνάμεις μεταξύ τους από τα μόρια αερίου.
* Μέτρια κινητική ενέργεια: Τα υγρά μόρια κινούνται πιο αργά και λιγότερο τυχαία από τα μόρια αερίου.
* Μικρότερες διαμοριακές αποστάσεις: Τα υγρά μόρια είναι πιο κοντά από τα μόρια αερίου.
* Αδυναμία: Τα υγρά είναι δύσκολο να συμπιεστεί επειδή τα μόρια είναι ήδη κοντά.
* σταθερός όγκος, αλλά χωρίς σταθερό σχήμα: Τα υγρά παίρνουν το σχήμα του δοχείου τους, αλλά διατηρούν σταθερό όγκο.
Βασικές διαφορές:
* Διαμοριακές δυνάμεις: Η κύρια διαφορά έγκειται στη δύναμη των διαμοριακών δυνάμεων. Τα αέρια έχουν πολύ αδύναμες δυνάμεις, ενώ τα υγρά έχουν ισχυρότερες δυνάμεις.
* Μοριακή διάταξη: Τα μόρια αερίου είναι πολύ μακριά και τυχαία κινούνται, ενώ τα υγρά μόρια είναι πιο κοντά και έχουν μια πιο δομημένη διάταξη.
* Συμπιτιστικότητα: Τα αέρια είναι εύκολα συμπιεσμένα λόγω μεγάλων διαμοριακών αποστάσεων, ενώ τα υγρά είναι σχεδόν ασυμπίεστα.
Σημείωση: Ενώ η χημική σύνθεση παραμένει η ίδια, οι αλλαγές στη μοριακή διάταξη και στις αλληλεπιδράσεις οδηγούν σε σημαντικές αλλαγές στις φυσικές ιδιότητες μιας ουσίας.