Γιατί η ναφθαλίνης είναι πιο διαλυτή στον αιθέρα πετρελαίου από το νερό;
* Δομή της ναφθαλίνης: Το ναφθαλίνιο είναι ένα μη πολικό μόριο με επίπεδη δομή που αποτελείται από δύο συντηγμένους δακτυλίους βενζολίου. Οι κύριες διαμοριακές δυνάμεις του είναι δυνάμεις van der Waals.
* πετρελαϊκός αιθέρα: Ο πετρελαϊκός αιθέρας είναι ένας μη πολικός διαλύτης. Πρόκειται για ένα μείγμα υδρογονανθράκων, κυρίως πεντάν και εξάνιο.
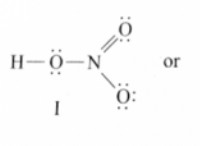
* νερό: Το νερό είναι ένας πολικός διαλύτης και η κύρια διαμοριακή δύναμη είναι η δέσμευση υδρογόνου.
γιατί "όπως διαλύεται όπως" ισχύει:
* Οι μη πολικοί διαλύτες διαλύουν μη πολικές διαλυμένες ουσίες: Οι μη πολικοί διαλύτες όπως ο πετρελαϊκός αιθέρας έχουν αδύναμες διαμοριακές δυνάμεις. Για να διαλυθεί μια διαλυμένη ουσία, ο διαλύτης πρέπει να ξεπεράσει τις ενδομοριακές δυνάμεις της διαλυμένης ουσίας και να δημιουργήσει νέες αλληλεπιδράσεις. Δεδομένου ότι η ναφθαλίν και ο πετρελαϊκός αιθέρας έχουν και τις αδύναμες δυνάμεις van der Waals, μπορούν να αλληλεπιδρούν εύκολα, οδηγώντας σε καλή διαλυτότητα.
* Οι πολικοί διαλύτες διαλύουν πολικές διαλυμένες ουσίες: Το νερό, με την ισχυρή σύνδεση υδρογόνου του, μπορεί να διαλύσει πολικές διαλυμένες ουσίες που μπορούν να σχηματίσουν δεσμούς υδρογόνου με μόρια νερού.
Γιατί το ναφθαλίνιο δεν είναι διαλυτό στο νερό:
* Η μη πολική δομή της ναφθαλίνης την εμποδίζει να σχηματίζει ισχυρές αλληλεπιδράσεις με τα πολικά μόρια του νερού. Η ενέργεια που απαιτείται για την αντιμετώπιση των δεσμών υδρογόνου στο νερό και τη δημιουργία νέων αλληλεπιδράσεων με ναφθαλίνιο είναι σημαντική, με αποτέλεσμα τη χαμηλή διαλυτότητα.
Συνοπτικά: Το ναφθαλίνιο, που είναι ένα μη πολικό μόριο, είναι πιο διαλυτό σε μη πολικό διαλύτη όπως ο πετρελαϊκός αιθέρας επειδή οι διαμοριακές δυνάμεις τους είναι συμβατές. Η έλλειψη πολικότητας της καθιστά ασυμβίβαστη με το νερό, με αποτέλεσμα την κακή διαλυτότητα.