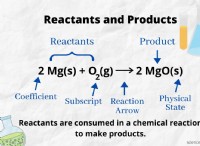
Γιατί ορισμένα ισότοπα γράφτηκαν χωρίς τον ατομικό αριθμό του;
* Πλαίσιο: Ο ατομικός αριθμός συχνά παραλείπεται όταν το πλαίσιο καθιστά σαφές. Για παράδειγμα, εάν συζητάτε τα ισότοπα του άνθρακα, μπορεί να δείτε:
* ¹²c (Carbon-12)
* ¹³c (Carbon-13)
* ⁴C (άνθρακα-14)
Δεδομένου ότι μιλάτε ήδη για τον άνθρακα, υπονοείται ο ατομικός αριθμός (6).
* Σαφήνεια: Σε ορισμένες περιπτώσεις, η σύνταξη του ατομικού αριθμού μπορεί να είναι περιττή. Για παράδειγμα, σε πυρηνική αντίδραση, είναι συχνά πιο εύκολο να ακολουθήσετε τις αλλαγές εάν γράφετε μόνο τους αριθμούς μάζας:
* ⁴n + ¹n → ⁴c + ¹h
Μπορείτε να υπολογίσετε τους ατομικούς αριθμούς αφαιρώντας τον αριθμό μάζας από τον αριθμό νετρονίων (ο οποίος συνήθως παραλείπεται).
* Πρότυπη σημείωση: Σε ορισμένους επιστημονικούς τομείς, ενδέχεται να υπάρχουν συγκεκριμένες συμβάσεις. Μπορεί να βλέπετε ισότοπα να γράφονται διαφορετικά στην πυρηνική φυσική παρά στη χημεία.
Ωστόσο, είναι πάντα καλύτερο να γράφετε τον ατομικό αριθμό εάν υπάρχει πιθανότητα ασάφειας. Εάν δεν είστε σίγουροι για το πλαίσιο, είναι καλύτερο να είστε σαφείς και να το συμπεριλάβετε.