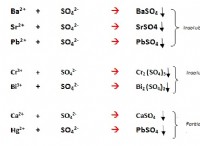
Τι είδους δεσμοί σχηματίζονται τυπικά από αλκαλικά μέταλλα;
Εδώ είναι γιατί:
* Ενέργεια χαμηλής ιονισμού: Τα αλκαλικά μέταλλα έχουν μόνο ένα ηλεκτρόνιο στο εξωτερικό τους κέλυφος. Χάνουν εύκολα αυτό το ηλεκτρόνιο για να σχηματίσουν ένα κατιόν +1, λόγω της χαμηλής ενέργειας ιονισμού τους.
* Υψηλή ηλεκτροδιαστικότητα: Η χαμηλή ηλεκτροαρνητικότητα τους σημαίνει ότι έχουν έντονη τάση να χάσουν ηλεκτρόνια.
* Αντίδραση με μη μέταλλα: Όταν αντιδρούν με μη μέταλλα (τα οποία έχουν υψηλή ηλεκτροαρνητικότητα και τείνουν να κερδίζουν ηλεκτρόνια), το αλκαλικό μέταλλο χάνει το ηλεκτρόνιο του, σχηματίζοντας ένα θετικό ιόν και το μη μέταλλο κερδίζει, σχηματίζοντας ένα αρνητικό ιόν. Αυτά τα αντίθετα φορτισμένα ιόντα προσελκύουν ο ένας τον άλλον, σχηματίζοντας έναν ιοντικό δεσμό.
Παράδειγμα: Το νάτριο (Na) αντιδρά με χλώριο (CL) για να σχηματίσει χλωριούχο νάτριο (NaCl), μια κλασική ιοντική ένωση. Το νάτριο χάνει το ηλεκτρόνιο του για να σχηματίσει Na+, ενώ το χλώριο κερδίζει για να σχηματίσει cl-. Η ηλεκτροστατική έλξη μεταξύ αυτών των ιόντων σχηματίζει τον ιοντικό δεσμό σε NaCl.