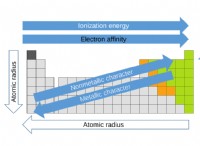
Ποια είναι τα παραδείγματα της ηλεκττονικότητας;
Ακολουθεί μια κατανομή της ηλεκτροαρνητικότητας και πώς λειτουργεί:
Τι είναι η ηλεκτροαρνητικότητα;
* Η ηλεκτροαρνητικότητα είναι ένα μέτρο της ικανότητας ενός ατόμου να προσελκύει ηλεκτρόνια προς τον εαυτό του όταν σχηματίζει χημικό δεσμό με ένα άλλο άτομο.
* Όσο υψηλότερη είναι η τιμή ηλεκτροαρνητικότητας, τόσο ισχυρότερη είναι η έλξη των ηλεκτρονίων του ατόμου.
Παραδείγματα για τον τρόπο με τον οποίο παίζει η ηλεκτροαρνητικότητα:
* πολικοί ομοιοπολικοί δεσμοί: Όταν δύο άτομα με διαφορετικό δεσμό ηλεκτροναριναρίων, τα ηλεκτρόνια τραβιούνται πιο έντονα προς το άτομο με την υψηλότερη ηλεκτροαρνητικότητα. Αυτό δημιουργεί ένα πολικό δεσμό , όπου το ένα άκρο του δεσμού είναι ελαφρώς αρνητικό και το άλλο άκρο είναι ελαφρώς θετικό. Για παράδειγμα, στο μόριο νερού (H₂O), το οξυγόνο έχει υψηλότερη ηλεκτροαρνητικότητα από το υδρογόνο, έτσι ώστε τα ηλεκτρόνια να ξοδεύουν περισσότερο χρόνο γύρω από το άτομο οξυγόνου, καθιστώντας το ελαφρώς αρνητικό και τα άτομα υδρογόνου ελαφρώς θετικά.
* Ιονικά ομόλογα: Όταν η διαφορά στην ηλεκτροαρνητικότητα μεταξύ δύο ατόμων είναι πολύ μεγάλη, ένα άτομο μπορεί να κλέψει εντελώς ένα ηλεκτρόνιο από το άλλο. Αυτό δημιουργεί ιόντα (φορτισμένα άτομα) και έχει ως αποτέλεσμα ένα ιονικό δεσμό . Για παράδειγμα, στο επιτραπέζιο αλάτι (NaCl), το νάτριο (NA) έχει χαμηλή ηλεκτροαρνητικότητα και χάνει ένα ηλεκτρόνιο στο χλώριο (CL), το οποίο έχει υψηλή ηλεκτροαρνητικότητα.
* Πρόβλεψη τύπων δεσμών: Συγκρίνοντας τις τιμές ηλεκτροαρνητικότητας των ατόμων, μπορείτε να προβλέψετε εάν ένας δεσμός θα είναι ιοντικός, πολικός ομοιοπολικός ή μη πολικός ομοιοπολικός.
Παραδείγματα τιμών ηλεκτροαρνητικότητας:
* Φθορίνη (F): 4.0 (υψηλότερη ηλεκτροαρνητικότητα)
* οξυγόνο (o): 3.5
* αζώτου (n): 3.0
* χλώριο (CL): 3.0
* άνθρακα (c): 2.5
* υδρογόνο (h): 2.1
* λίθιο (li): 1.0 (χαμηλότερη ηλεκτροαρνητικότητα)
Βασικά σημεία:
* Η ηλεκτροαρνητικότητα είναι ένα σχετικό Έννοια - συγκρίνετε την ηλεκτροαρνητικότητα δύο ατόμων για να καταλάβετε πώς θα αλληλεπιδρούν.
* Είναι μια θεμελιώδης ιδιοκτησία των ατόμων που επηρεάζουν τη χημική σύνδεση και τη μοριακή συμπεριφορά.
Επιτρέψτε μου να ξέρω αν θα θέλατε να επεξεργαστώ σε οποιοδήποτε από αυτά τα σημεία ή να έχω περισσότερες ερωτήσεις σχετικά με την ηλεκτροαρνητικότητα!