Πώς είναι η διαφορά μεταξύ πολικών και μη σχετιζόμενων με το ηλεκτροαρνητικό;
Ηλεκτροργατιστικότητα:
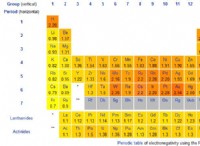
* Ορισμός: Η ηλεκτροαρνητικότητα είναι το μέτρο της ικανότητας ενός ατόμου να προσελκύει ηλεκτρόνια προς τον εαυτό του όταν σχηματίζει χημικό δεσμό.
* Τάση στον περιοδικό πίνακα: Η ηλεκτροαρνητικότητα γενικά αυξάνεται από αριστερά προς τα δεξιά κατά τη διάρκεια μιας περιόδου και μειώνεται με τη μείωση μιας ομάδας.
πολικοί ομοιοπολικοί δεσμοί:
* σχηματισμός: Όταν δύο άτομα με σημαντικά διαφορετική ηλεκτροαρνητικότητα Δημιουργήστε ένα δεσμό, τα ηλεκτρόνια δεν μοιράζονται εξίσου. Το άτομο με υψηλότερη ηλεκτροαρνητικότητα προσελκύει τα ηλεκτρόνια πιο έντονα, δημιουργώντας ένα μερικό αρνητικό φορτίο (δ-) σε αυτό το άτομο και ένα μερικό θετικό φορτίο (δ+) από το άλλο άτομο.
* Παράδειγμα: Σε ένα μόριο νερού (H₂O), το οξυγόνο έχει υψηλότερη ηλεκτροαρνητικότητα από το υδρογόνο. Αυτό δημιουργεί έναν πολικό ομοιοπολικό δεσμό όπου το οξυγόνο έχει μερικό αρνητικό φορτίο και το υδρογόνο έχει ένα μερικό θετικό φορτίο.
μη πολικά ομοιοπολικά ομόλογα:
* σχηματισμός: Όταν δύο άτομα με παρόμοια ή ταυτόσημη ηλεκτροαρνητικότητα σχηματίζουν έναν δεσμό, τα ηλεκτρόνια μοιράζονται εξίσου. Δεν υπάρχει διαχωρισμός του φορτίου και ο δεσμός είναι μη πολικός.
* Παράδειγμα: Σε ένα μόριο μεθανίου (CH₄), ο άνθρακας και το υδρογόνο έχουν παρόμοιες ηλεκτροθετικές ιδιότητες. Τα ηλεκτρόνια μοιράζονται εξίσου, με αποτέλεσμα έναν μη πολικό δεσμό.
σχέση με τη μοριακή πολικότητα:
* πολικά μόρια: Μόρια με πολικούς δεσμούς και ασύμμετρο σχήμα θεωρούνται πολικοί. Η άνιση κατανομή του φορτίου οδηγεί σε θετικό και αρνητικό τέλος (διπολική στιγμή).
* Μη πολικά μόρια: Μόρια με μη πολικούς δεσμούς ή συμμετρικά σχήματα όπου οι πολικοί δεσμοί ακυρώνονται ο ένας τον άλλον θεωρούνται μη πολικοί. Έχουν ομοιόμορφη κατανομή της χρέωσης.
Συνοπτικά:
* Οι διαφορές ηλεκτροαρνητικότητας οδηγούν τον σχηματισμό πολικών ή μη πολικών ομοιοπολικών δεσμών.
* Οι πολικοί δεσμοί προκύπτουν από την άνιση κατανομή των ηλεκτρονίων λόγω των διαφορών ηλεκτροαρνητικότητας.
* Οι μη πολικοί δεσμοί προκύπτουν από την ίση κατανομή των ηλεκτρονίων λόγω παρόμοιας ηλεκτροαρνητικότητας.
* Η μοριακή πολικότητα εξαρτάται από την παρουσία πολικών δεσμών και το συνολικό σχήμα του μορίου.