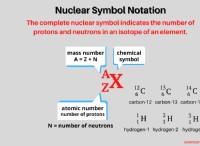
Τι είδους αλλαγή μπορούν να έχουν τα ιόντα;
1. Αλλαγές υπεύθυνοι:
* Οξείδωση: Απώλεια ηλεκτρονίων, με αποτέλεσμα ένα πιο θετικό φορτίο.
* Μείωση: Κερδίζοντας ηλεκτρόνια, με αποτέλεσμα ένα πιο αρνητικό φορτίο.
* Αντιδράσεις οξειδοαναγωγής: Ταυτόχρονη οξείδωση και μείωση διαφορετικών ειδών.
2. Αλλαγές στη χημική σύνθεση:
* Σχηματισμός νέων ενώσεων: Τα ιόντα μπορούν να συνδυαστούν με άλλα ιόντα ή μόρια για να σχηματίσουν νέες ενώσεις. Για παράδειγμα, τα ιόντα νατρίου (Na+) και τα ιόντα χλωριούχου (Cl-) συνδυάζονται για να σχηματίσουν τραπεζομάντιλο αλάτι (NaCl).
* αποσύνθεση: Τα ιόντα μπορούν να διασπαστούν σε απλούστερα ιόντα ή μόρια. Για παράδειγμα, ένα ιόν ανθρακικό (CO3 2-) μπορεί να αποσυντεθεί σε ένα μόριο διοξειδίου του άνθρακα (CO2) και ένα ιόν οξειδίου (Ο2-).
3. Αλλαγές στη φυσική κατάσταση:
* Αλλαγές φάσης: Τα ιόντα μπορούν να αλλάξουν τη φυσική τους κατάσταση, όπως από ένα στερεό σε ένα υγρό ή από ένα αέριο σε ένα υγρό.
* Διάλυση: Τα ιόντα μπορούν να διαλύονται σε έναν διαλύτη, όπως το νερό, για να σχηματίσουν μια λύση.
4. Αλλαγές στην ενέργεια:
* Θερμότητα σχηματισμού: Η αλλαγή ενέργειας που σχετίζεται με το σχηματισμό ενός ιόντος από τα συστατικά του στοιχεία.
* Πλέγμα ενέργειας: Η ενέργεια που απαιτείται για τον διαχωρισμό ενός γραμμομόρου μιας συμπαγής ιοντικής ένωσης στα αέρια της ιόντα.
5. Αλλαγές στη συμπεριφορά:
* Βιολογική δραστηριότητα: Τα ιόντα διαδραματίζουν κρίσιμους ρόλους σε διάφορες βιολογικές διεργασίες, όπως νευρικές παρορμήσεις, μυϊκές συστολές και ενζυματικές αντιδράσεις. Οι αλλαγές στη συγκέντρωση των ιόντων μπορούν να μεταβάλουν αυτές τις διαδικασίες.
Παραδείγματα:
* Τα ιόντα σιδήρου (II) (Fe2+) μπορούν να οξειδωθούν σε ιόντα σιδήρου (III) (Fe3+) χάνοντας ένα ηλεκτρόνιο.
* Τα ιόντα νατρίου (Na+) σε ένα διάλυμα άλατος μπορούν να αντιδράσουν με ιόντα χλωριούχου (Cl-) για να σχηματίσουν κρυστάλλους χλωριούχου νατρίου (NaCl)
* Ένα ιόν ανθρακικού ασβεστίου (CACO3 2-) μπορεί να αποσυντεθεί σε οξείδιο του ασβεστίου (CAO) και διοξείδιο του άνθρακα (CO2) όταν θερμαίνεται.
Συνοπτικά, τα ιόντα μπορούν να υποβληθούν σε διάφορες αλλαγές στη φόρτιση, τη χημική σύνθεση, τη φυσική κατάσταση, την ενέργεια και τη συμπεριφορά. Αυτές οι αλλαγές είναι θεμελιώδεις για πολλές χημικές και βιολογικές διεργασίες.