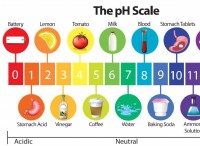
Τι ενεργεί ένας διαλύτης για χημικές αντιδράσεις;
Κοινοί διαλύτες:
* νερό (h₂o): Ο πιο συνηθισμένος διαλύτης, ιδιαίτερα για αντιδράσεις που περιλαμβάνουν ιοντικές ενώσεις (άλατα) και πολικά μόρια. Το νερό είναι ένας πολικός διαλύτης, που σημαίνει ότι έχει θετικό και αρνητικό τέλος, επιτρέποντάς του να διαλύσει ουσίες με παρόμοιες πολικότητες.
* Οργανικοί διαλύτες: Αυτές περιλαμβάνουν αλκοόλες (μεθανόλη, αιθανόλη), αιθέρες (διαιθυλαιθέρα), υδρογονάνθρακες (εξάνιο, βενζόλιο) και κετόνες (ακετόνη). Οι οργανικοί διαλύτες χρησιμοποιούνται συχνά για αντιδράσεις που περιλαμβάνουν μη πολικές ενώσεις.
* οξέα και βάσεις: Τα ισχυρά οξέα και οι βάσεις, όπως το υδροχλωρικό οξύ (HCl) και το υδροξείδιο του νατρίου (ΝΑΟΗ), μπορούν επίσης να δρουν ως διαλύτες. Μπορούν να πρωτονικά ή να αποπρωνεθούν αντιδραστήρια, επηρεάζοντας την οδό αντίδρασης.
Παράγοντες που επηρεάζουν την επιλογή του διαλύτη:
* Διαλυτότητα των αντιδραστηρίων: Ο διαλύτης πρέπει να διαλύσει τα αντιδραστήρια για να τους επιτρέψει να αλληλεπιδρούν και να σχηματίζουν προϊόντα.
* Μηχανισμός αντίδρασης: Ο διαλύτης μπορεί να επηρεάσει τον μηχανισμό αντίδρασης και να επηρεάσει τον ρυθμό της αντίδρασης.
* Διαλυτότητα προϊόντων: Ο διαλύτης δεν πρέπει να παρεμβαίνει στην απομόνωση και τον καθαρισμό του επιθυμητού προϊόντος.
* Ασφάλεια και περιβαλλοντικές εκτιμήσεις: Ο διαλύτης θα πρέπει να είναι ασφαλής στη διαχείριση και φιλικό προς το περιβάλλον.
Παραδείγματα:
* διάλυση αλατιού: Το νερό διαλύει το αλάτι του τραπεζιού (NaCl) διαχωρίζοντας τα θετικά φορτισμένα ιόντα νατρίου (Na⁺) και αρνητικά φορτισμένα ιόντα χλωριούχου (CL⁻).
* Εσττήριξη: Η αντίδραση ενός αλκοόλ με καρβοξυλικό οξύ για να σχηματίσει έναν εστέρα συχνά χρησιμοποιεί οργανικό διαλύτη όπως η μεθανόλη ή η αιθανόλη.
* αντιδράσεις Grignard: Αυτές οι αντιδράσεις, που περιλαμβάνουν ενώσεις οργανομαγνησίας, συνήθως χρησιμοποιούν διαλύτες αιθέρα όπως διαιθυλαιθέρα.
Συμπερασματικά:
Ο "διαλύτης" σε μια χημική αντίδραση δεν είναι μια ενιαία, καθολική οντότητα. Είναι ένα κρίσιμο συστατικό που επηρεάζει την πορεία της αντίδρασης και επιλέγεται με βάση τις συγκεκριμένες ανάγκες της αντίδρασης.