Τάση ατομικής ακτίνας

Η τάση της ατομικής ακτίνας περιγράφει πώς η ατομική ακτίνα αλλάζει καθώς μετακινείστε στον περιοδικό πίνακα των στοιχείων. Γενικά, η ατομική ακτίνα ενός στοιχείου τείνει να αυξάνεται καθώς μετακινείστε προς τα κάτω μια ομάδα στοιχείων στον περιοδικό πίνακα.
Για να κατανοήσουμε γιατί συμβαίνει αυτό, θα ήταν χρήσιμο να ρίξουμε μια προσεκτική ματιά στον ορισμό της ατομικής ακτίνας και της ακτίνας διαφορετικών στοιχείων στον περιοδικό πίνακα.
Τι είναι η ατομική ακτίνα;
Η ατομική ακτίνα αναφέρεται στο μέγεθος του ατόμου. Ωστόσο, αυτή η τιμή δεν είναι τόσο εύκολο να προσδιοριστεί όσο νομίζετε. Πρώτα απ 'όλα, είναι σημαντικό να γνωρίζετε το γεγονός ότι παρόλο που ο όρος ατομική ακτίνα χρησιμοποιείται για να αναφέρεται στο μέγεθος ενός ατόμου, δεν υπάρχει συμφωνημένος ορισμός για αυτήν την τιμή. Χρησιμοποιούνται διάφορες μέθοδοι μέτρησης της ατομικής ακτίνας, όπως η ιοντική ακτίνα, η μεταλλική ακτίνα, η ομοιοπολική ακτίνα και η ακτίνα Van der Waals.
Η ιοντική ακτίνα αναφέρεται στο μέτρο του ιόντος ενός ατόμου όταν βρίσκεται σε ένα κρυσταλλικό πλέγμα και είναι συνήθως η μισή απόσταση μεταξύ των πυρήνων δύο διαφορετικών ιόντων που μόλις αγγίζονται. Η ομοιοπολική ακτίνα είναι το μέγεθος ενός ατόμου που αποτελεί τμήμα ενός ομοιοπολικού δεσμού. Η μεταλλική ακτίνα αναφέρεται σε έναν συγκεκριμένο τύπο χημικού δεσμού μεταξύ θετικά φορτισμένων μεταλλικών ιόντων και ηλεκτρονίων αγωγιμότητας. Η μεταλλική ακτίνα ορίζεται συνήθως ως το ήμισυ της απόστασης μεταξύ δύο μεταλλικών ιόντων που βρίσκονται το ένα δίπλα στο άλλο σε ένα μεταλλικό πλέγμα. Η ακτίνα Van der Waals αναφέρεται στην απόσταση που υπάρχει μεταξύ της πλησιέστερης προσέγγισης δύο μη συνδεδεμένων ατόμων σε ένα καθορισμένο στοιχείο.
Τι είναι η τάση της ατομικής ακτίνας;
Ενώ η ατομική ακτίνα μπορεί να οριστεί με πολλούς διαφορετικούς τρόπους, η γενική τάση της ατομικής ακτίνας στον περιοδικό πίνακα ισχύει. Η ατομική ακτίνα για τα άτομα ενός στοιχείου τείνει να ανεβαίνει καθώς μετακινείστε προς τα κάτω μια ομάδα στοιχείων στον πίνακα. Η ατομική ακτίνα αυξάνεται καθώς μετακινείστε προς τα κάτω σε μια στήλη, επειδή για κάθε νέα γραμμή του πίνακα προστίθεται ένα νέο κέλυφος ηλεκτρονίων στο άτομο.
Ένα συμπέρασμα σε αυτό είναι ότι επειδή υπάρχουν περισσότερα ηλεκτρόνια ανά άτομο καθώς αυξάνεται ο ατομικός αριθμός, η ατομική ακτίνα μπορεί να μειωθεί καθώς διασχίζετε τον πίνακα από αριστερά προς τα δεξιά.
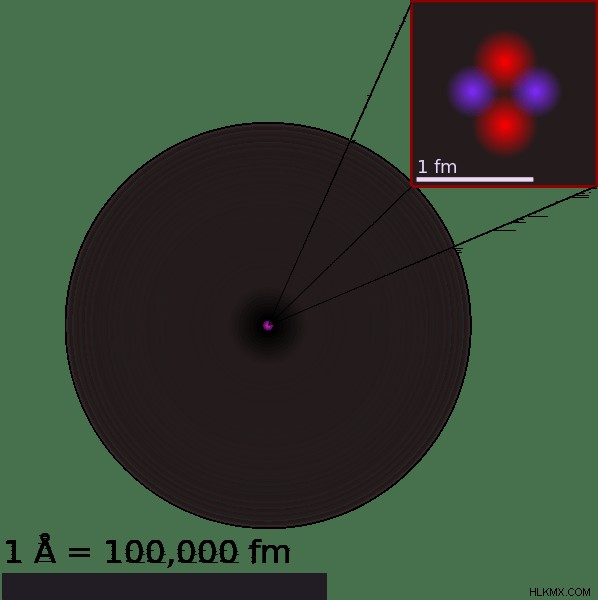
Πώς μετράται η ατομική ακτίνα;
Τα άτομα κινούνται συνεχώς, έτσι σημαίνει ότι οποιαδήποτε απόπειρα μέτρησης της ατομικής τους ακτίνας θα έχει ένα ορισμένο ποσό σφάλματος ενσωματωμένο. Η μέτρηση της ατομικής ακτίνας γίνεται με τη μέτρηση της απόστασης μεταξύ των πυρήνων δύο διαφορετικών ατόμων που μόλις αγγίζονται. Η διάμετρος της απόστασης μεταξύ των δύο πυρήνων διαιρείται με δύο για να ληφθεί η ακτίνα. Κατά τη μέτρηση της ατομικής ακτίνας πρέπει να θυμάστε ότι τα άτομα που μετρώνται δεν μπορούν να μοιραστούν έναν χημικό δεσμό μεταξύ τους. Αυτό συμβαίνει επειδή ένας χημικός δεσμός σημαίνει ότι τα ηλεκτρονιακά κελύφη των ατόμων επικαλύπτονται ή ότι μοιράζονται ένα εξωτερικό περίβλημα.
Διαφορά μεταξύ ατομικής ακτίνας και ιονικής ακτίνας
Η ιοντική ακτίνα και η ατομική ακτίνα είναι ισοδύναμες με οποιαδήποτε άτομα ουδέτερων στοιχείων όπως το κρυπτό, το νέο και το αργό. Ωστόσο, πολλά άτομα είναι τα πιο σταθερά όταν έχουν καθαρό θετικό φορτίο. Στην πράξη, αυτό σημαίνει ότι γίνονται κατιόντα (θετικά φορτισμένα ιόντα) όταν ρίχνουν το εξώτατο ηλεκτρόνιό τους. Όταν τα ηλεκτρόνια πέφτουν από ένα άτομο, το άτομο συχνά ρίχνει και το εξωτερικό του κέλυφος ηλεκτρονίων, γεγονός που έχει ως αποτέλεσμα να κάνει την ατομική ακτίνα μεγαλύτερη από την ιοντική ακτίνα.
Σε αντίθεση με το γεγονός ότι ορισμένα άτομα είναι πιο σταθερά με θετικό φορτίο, μερικά είναι πιο σταθερά με καθαρό αρνητικό φορτίο. Σε αυτή την περίπτωση, γίνονται πιο σταθερά αποκτώντας ένα ή περισσότερα ηλεκτρόνια, μετατρέπονται σε ανιόντα (αρνητικά φορτισμένα ιόντα). Ένα άλλο φλοιό ηλεκτρονίων δεν θα προστεθεί, ωστόσο, που σημαίνει ότι η διαφορά μεγέθους μεταξύ της ιοντικής ακτίνας και της ατομικής ακτίνας δεν είναι τόσο μεγάλη όσο η διαφορά που υπάρχει στα κατιόντα. Αυτό σημαίνει ότι η ατομική ακτίνα θα είναι πάντα η ίδια ή λίγο μικρότερη από την ιοντική ακτίνα. Γενικά, η τάση της ιοντικής ακτίνας έχει παρόμοια τάση με την ατομική ακτίνα, αυξάνοντας σε μέγεθος καθώς μετακινείστε στον περιοδικό πίνακα.
Άλλες τάσεις που βρέθηκαν στον περιοδικό πίνακα
Υπάρχουν και άλλες τάσεις που μπορούν να βρεθούν στον περιοδικό πίνακα, εκτός από την τάση της ατομικής ακτίνας. Άλλες τάσεις που βρέθηκαν στον περιοδικό πίνακα περιλαμβάνουν την τάση ηλεκτραρνητικότητας, την τάση ενέργειας ιονισμού και την τάση συγγένειας ηλεκτρονίων.
Η τάση ηλεκτραρνητικότητας αντανακλά το γεγονός ότι η τιμή ηλεκτραρνητικότητας ενός ατόμου αυξάνεται καθώς μετακινείστε αριστερά προς τα δεξιά σε ένα τμήμα στοιχείων. Η ηλεκτροαρνητικότητα μειώνεται επίσης καθώς μετακινείστε προς τα κάτω σε μια ομάδα στον πίνακα, από πάνω προς τα κάτω. Αξιοσημείωτες εξαιρέσεις στην τάση ηλεκτραρνητικότητας περιλαμβάνουν Ιανθανίδες, ακτινίδες και ευγενή αέρια. Τα μέταλλα μετάπτωσης έχουν μικρή απόκλιση σε αυτά.
Η τάση της ενέργειας ιονισμού αναφέρεται στον τρόπο με τον οποίο η ποσότητα της ενέργειας ιονισμού που απαιτείται για την απομάκρυνση ενός ηλεκτρονίου από ένα αέριο ουδέτερο άτομο αλλάζει στον περιοδικό πίνακα. Τα στοιχεία στη δεξιά πλευρά του περιοδικού πίνακα συνήθως χρειάζονται περισσότερη ενέργεια ιονισμού για να γίνουν κατιόν, ενώ τα στοιχεία στην αριστερή πλευρά του πίνακα συνήθως γίνονται κατιόντα πιο εύκολα. Με άλλα λόγια, η ενέργεια ιονισμού αυξάνεται καθώς κινείται κανείς κατά μήκος του τραπεζιού από αριστερά προς τα δεξιά.
Η τάση της συγγένειας ηλεκτρονίων παρακολουθεί τη συγγένεια ηλεκτρονίων ενός ατόμου, την ικανότητα ενός δεδομένου ατόμου να συνδέεται με ένα ηλεκτρόνιο. Όσο χαμηλότερη είναι η τιμή συγγένειας ηλεκτρονίων ενός ατόμου, τόσο πιο εύκολα ένα άτομο θα δεχτεί ένα ηλεκτρόνιο. Η συγγένεια ηλεκτρονίων συνήθως πέφτει καθώς κάποιος κινείται προς τα κάτω σε μια ομάδα στοιχείων. Καθώς μετακινείστε αριστερά προς τα δεξιά κατά μήκος του περιοδικού πίνακα, η συγγένεια ηλεκτρονίων αυξάνεται.
Παραδείγματα ατομικής ακτίνας
Ας ρίξουμε μια γρήγορη ματιά σε μερικά παραδείγματα ατομικής ακτίνας. Αυτές οι ατομικές ακτίνες μετρώνται σε πικόμετρα:
- Το στοιχείο Υδρογόνο (Η) έχει ατομική ακτίνα 37.
- Το νάτριο (Na) έχει ατομική ακτίνα 186.
- Το κάλιο (Κ) έχει ατομική ακτίνα 227.
- Το ρουβίδιο (Rb) έχει ατομική ακτίνα 248.
- Το καίσιο (Cs) έχει ατομική ακτίνα 265.
Σημειώστε ότι όλα αυτά τα στοιχεία βρίσκονται στην πρώτη στήλη του περιοδικού πίνακα και ότι παρουσιάζονται με φθίνουσα σειρά. Αυτό δείχνει καθαρά πώς αυξάνεται η ατομική ακτίνα καθώς μετακινείστε προς τα κάτω στον περιοδικό πίνακα.




