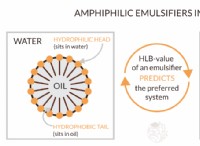
O2 (Oxygen) Lewis Dot Structure

Η Δομή Lewis Dot για O2 ή διοξυγόνο έχει ως εξής:
O =O
Είναι μια πολύ απλή δομή, αλλά πώς ερμηνεύει κανείς αυτή τη δομή Lewis; Πώς μπορεί κανείς να σχεδιάσει μια δομή Lewis και να τη χρησιμοποιήσει για να καταλάβει πώς τα άτομα συνδέονται μεταξύ τους για να δημιουργήσουν μόρια; Ας δούμε πώς ερμηνεύονται και σχεδιάζονται οι δομές Lewis.
Στοιχεία για το οξυγόνο (O2)
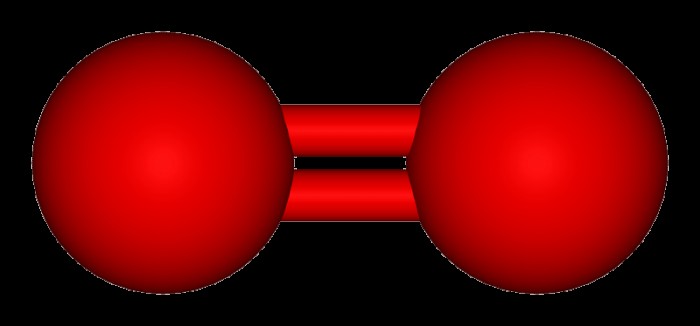
Το O2 είναι ένα αλλοτρόπο του οξυγόνου και αποτελείται από δύο άτομα οξυγόνου συνδεδεμένα μεταξύ τους. Αν και ο χημικός τύπος για αυτό το αλλοτρόπιο είναι O2, συχνά αναφέρεται απλώς ως οξυγόνο. Το O2 ή το συγκεκριμένο σκεύασμα του διοξυγόνου είναι μια από τις πιο κοινές στοιχειώδεις ενώσεις στον πλανήτη, που αποτελεί περίπου το 20,8% της ατμόσφαιρας της Γης. Το διοξυγόνο (O2) χρησιμοποιείται στην κυτταρική αναπνοή από πολλούς ζωντανούς οργανισμούς και χρησιμοποιείται για τη δημιουργία ενέργειας μαζί με τα σάκχαρα.
Πώς να ερμηνεύσετε μια δομή Lewis
Οι δομές Lewis είναι διαγράμματα που αντιπροσωπεύουν τα άτομα και τους δεσμούς μεταξύ τους. Τα γράμματα αντιπροσωπεύουν τα άτομα που βρίσκονται μέσα στο μόριο, με συγκεκριμένα γράμματα που αντιπροσωπεύουν διαφορετικά στοιχεία. Εν τω μεταξύ, οι παύλες αντιπροσωπεύουν τους δεσμούς μεταξύ των διαφορετικών ατόμων. Οι τελείες μπορούν επίσης να βρεθούν στη δομή Lewis, είτε χρησιμοποιούνται για να αναπαραστήσουν δεσμούς (όπως παύλες) είτε χρησιμοποιούνται για να υποδηλώσουν μοναχικά ζεύγη. Τα μεμονωμένα ζεύγη ηλεκτρονίων αναπαρίστανται συχνά με κουκκίδες που περιβάλλουν μεμονωμένα άτομα. Εν τω μεταξύ, οι διπλοί δεσμοί αντιπροσωπεύονται με διπλές γραμμές, επεκτείνοντας φυσικά την ιδέα ότι οι απλές γραμμές αντιπροσωπεύουν έναν απλό δεσμό μεταξύ των ατόμων.
Ο κανόνας της οκτάδας είναι ένας κανόνας που δηλώνει ότι η διαμόρφωση ηλεκτρονίων των ευγενών αερίων μπορεί εύκολα να επιτευχθεί μέσω του σχηματισμού δεσμών ζευγών ηλεκτρονίων μεταξύ των ατόμων. Πολλά άτομα έχουν ζεύγη ηλεκτρονίων στην οκτάδα τους τα οποία δεν μοιράζονται μεταξύ διαφορετικών ατόμων, ζεύγη που βρίσκονται μόνα τους. Για το λόγο αυτό, αυτά τα μη δεσμευτικά ηλεκτρόνια αναφέρονται ως μοναχικά ζεύγη. Αν και τα μεμονωμένα ζεύγη δεν εμπλέκονται στο σχηματισμό δεσμών μεταξύ των ατόμων, οι δομές Lewis θα πρέπει πάντα να σχεδιάζονται με μοναχικά ζεύγη που αντανακλώνται.
Πώς να σχεδιάσετε μια δομή Lewis Dot

Επειδή οι δομές Lewis είναι απλώς γραφικές αναπαραστάσεις του δεσμού μεταξύ διαφόρων ατόμων, μπορούν να χρησιμοποιηθούν για να βοηθήσουν στην πρόβλεψη του πώς τα άτομα θα συνδεθούν μεταξύ τους για να δημιουργήσουν μόρια. Οι δομές Lewis μπορούν να βοηθήσουν κάποιον να κατανοήσει πώς συνδέονται τα ηλεκτρόνια μεταξύ τους και πώς η διάταξη του μορίου επηρεάζεται από τον αριθμό των ηλεκτρονίων που υπάρχουν στο κέλυφος σθένους του ηλεκτρονίου. Η σχεδίαση της δομής Lewis μόνοι σας μπορεί να διευκολύνει την κατανόηση και την ερμηνεία των δομών Lewis, και επομένως συνιστάται να αναλύσετε τη δημιουργία της δομής Lewis σε μερικά απλά βήματα.
Το πρώτο μέρος της δημιουργίας μιας δομής Lewis είναι η ανάλυση του μορίου στο σύνολό του και η μέτρηση πόσων ηλεκτρονίων σθένους διαθέτει το μόριο συνολικά. Πρέπει να ληφθούν υπόψη όλα τα ηλεκτρόνια σθένους στο μόριο. Τα ηλεκτρόνια σθένους είναι τα ηλεκτρόνια που βρίσκονται στο εξωτερικό περίβλημα του ατόμου, το οποίο αναφέρεται ως κέλυφος σθένους. Τα άτομα διαθέτουν διαφορετικά στρώματα κελύφους και καθένα από αυτά τα στρώματα έχει τον δικό του αριθμό ηλεκτρονίων. Ωστόσο, τα ηλεκτρόνια που βρίσκονται στα εσωτερικά κελύφη συνήθως δεν λαμβάνονται υπόψη κατά την ανάλυση του δεσμού των ατόμων, επειδή, συνήθως, μόνο τα ηλεκτρόνια του φλοιού σθένους μπορούν να σχηματίσουν δεσμούς με άλλα άτομα. Επειδή τα ηλεκτρόνια του κελύφους σθένους είναι τα ηλεκτρόνια που δημιουργούν τα μόρια, είναι σημαντικό να γνωρίζουμε πόσα ηλεκτρόνια σθένους διαθέτει το μόριο συνολικά προκειμένου να σχεδιάσουμε μια δομή Lewis.
Η δεύτερη φάση της σχεδίασης του διαγράμματος Lewis είναι ο καθορισμός του πόσα ηλεκτρόνια και ένα δεδομένο άτομο χρειάζεται για να είναι ευτυχισμένο ή ικανοποιημένο. Τα άτομα πρέπει να έχουν μια ορισμένη ποσότητα ηλεκτρονίων στο εξωτερικό τους περίβλημα για να ικανοποιηθούν ή να μην επιθυμούν άλλα ηλεκτρόνια στο εξωτερικό περίβλημα. Ενώ το εξωτερικό περίβλημα του ηλεκτρονίου δεν είναι απαραίτητα σε χωρητικότητα όταν βρίσκεται σε αυτή την κατάσταση, η προσθήκη περισσότερων ηλεκτρονίων γίνεται όλο και πιο δύσκολη. Ένας ευρετικός που μπορεί να χρησιμοποιηθεί για να προσδιορίσει πόσα ηλεκτρόνια απαιτούνται από ένα στοιχείο για να ικανοποιηθεί είναι ο κανόνας της οκτάδας, ο οποίος αναφέρεται στο γεγονός ότι πολλά από τα στοιχεία του περιοδικού πίνακα, τα στοιχεία της κύριας ομάδας, τείνουν να απαιτούν οκτώ ηλεκτρόνια. μέσα στο εξωτερικό τους κέλυφος για να ικανοποιηθούν.
Το τρίτο μέρος της δημιουργίας μιας δομής κουκίδων Lewis είναι ο υπολογισμός του αριθμού των δεσμών που έχει το μόριο συνολικά. Ομοιοπολικοί δεσμοί είναι οι δεσμοί που σχηματίζουν ζεύγη ηλεκτρονίων, που δημιουργούνται όταν το ηλεκτρόνιο του ενός ατόμου ενώνεται με το ηλεκτρόνιο του άλλου ατόμου του δεσμού. Όταν το κάνετε αυτό, θυμηθείτε ότι προσδιορίσατε τον αριθμό των ηλεκτρονίων που είναι απαραίτητα για τη δημιουργία ενός δεσμού στο Βήμα 2 της δημιουργίας της δομής Lewis. Θα πρέπει επίσης να γνωρίζετε τον αριθμό των ηλεκτρονίων που υπάρχουν στο κέλυφος σθένους κάθε μεμονωμένου ατόμου αφού τον υπολογίσατε στο Βήμα 1. Θα πρέπει να είναι αρκετά εύκολο να προσδιοριστεί ο συνολικός αριθμός δεσμών μέσα στο μόριο, καθώς το μόνο που πρέπει να κάνετε είναι να αφαιρέσετε το αριθμός ατόμων που απαιτούν οι οκτάδες να συμπληρωθούν από τον συνολικό αριθμό ηλεκτρονίων σθένους. Φροντίστε να διαιρέσετε τον αριθμό των ηλεκτρονίων στο μισό γιατί απαιτούνται δύο ηλεκτρόνια για κάθε δεσμό.
Το τέταρτο βήμα στη δημιουργία μιας δομής κουκίδων Lewis είναι η επιλογή ενός κεντρικού ατόμου. Το κεντρικό άτομο είναι το άτομο από το οποίο θα διακλαδιστούν τα άλλα άτομα. Όπως αναφέρθηκε παραπάνω, το κεντρικό άτομο στη δομή Lewis είναι συνήθως το άτομο που έχει τη χαμηλότερη ηλεκτραρνητικότητα ή το υψηλότερο σθένος ηλεκτρονίων. Μπορεί κανείς να χρησιμοποιήσει την τάση ηλεκτραρνητικότητας στον περιοδικό πίνακα για να προσδιορίσει την ηλεκτραρνητικότητα ενός δεδομένου ατόμου. Υπάρχουν επίσης πίνακες που έχουν συγκεκριμένες τιμές ηλεκτραρνητικότητας που μπορεί κανείς να συμβουλευτεί. Η τάση ηλεκτραρνητικότητας περιγράφει μια τάση που βρίσκεται στον περιοδικό πίνακα όπου η ηλεκτραρνητικότητα αυξάνεται καθώς ακολουθεί κανείς τον πίνακα από αριστερά προς τα δεξιά και μειώνεται καθώς ακολουθεί τον πίνακα προς τα κάτω. Τα άτομα αλογόνου και τα άτομα υδρογόνου συνήθως δεν επιλέγονται ως το κεντρικό άτομο επειδή εμφανίζονται συνήθως στο εξωτερικό του μορίου.
Μόλις επιλεγεί ένα κεντρικό άτομο, μπορεί να σχεδιαστεί η σκελετική δομή του μορίου. Ξεκινήστε σχεδιάζοντας το κεντρικό άτομο και στη συνέχεια σχεδιάστε τα άτομα που το περιβάλλουν. Συνδέστε τα γύρω άτομα με το κεντρικό άτομο με γραμμές που αντιπροσωπεύουν δεσμούς. Το κεντρικό άτομο ενός μορίου είναι ικανό να ενωθεί με έως και τέσσερα άλλα άτομα. Αφού σχεδιαστεί το κεντρικό άτομο, μαζί με τις συνδέσεις του με άλλα άτομα, μπορείτε να τοποθετήσετε ηλεκτρόνια γύρω από τα άτομα. Τα μη δεσμευμένα ηλεκτρόνια πρέπει να έλκονται στο εξωτερικό των ατόμων. Απαιτούνται πλήρεις οκτάδες στο εξωτερικό των ατόμων, πράγμα που σημαίνει ότι εάν ξαφνικά ανακαλύψετε ότι δεν έχετε τη σωστή ποσότητα ηλεκτρονίων για να μετακινηθείτε, η σκελετική δομή που σχεδιάστηκε πριν δεν ήταν σωστά ευθυγραμμισμένη.
Μπορεί να είναι απαραίτητο να πειραματιστείτε στην αρχή, μαθαίνοντας τις περιπλοκές της σχεδίασης της δομής με δοκιμή και λάθος, αν και αυτό θα γίνει ευκολότερο με την εξάσκηση. Αφού σχεδιάσετε το κεντρικό άτομο και τα διακλαδιζόμενα άτομα του, τα ηλεκτρόνια που δεν έχουν χρησιμοποιηθεί θα πρέπει να σχεδιαστούν γύρω από το εξωτερικό του κεντρικού ατόμου. Η ολοκλήρωση της οκτάδας σημαίνει ότι οι δεσμοί που έχουν απομείνει πρέπει να γίνουν διπλοί δεσμοί, τους οποίους μπορείτε να αναπαραστήσετε σχεδιάζοντας δύο γραμμές παράλληλες μεταξύ τους. Εάν το άτομο δεν είναι μία από τις εξαιρέσεις στον κανόνα της οκτάδας, αλλά διαθέτει περισσότερα από οκτώ ηλεκτρόνια, είναι πιθανό να έγινε σφάλμα στην καταμέτρηση των ηλεκτρονίων κατά το Βήμα 1 της διαδικασίας.
Διαφορές μεταξύ των δομών Lewis και των πραγματικών μορίων
Η δημιουργία μιας δομής Lewis βοηθά στη διευκόλυνση της διαίσθησης του σχηματισμού και της δομής των μορίων. Ωστόσο, είναι σημαντικό να γνωρίζουμε ότι μοντέλα όπως η δομή Lewis απαιτούν έναν βαθμό απλοποίησης και επομένως υπάρχουν διαφορές μεταξύ των δομών Lewis και της δομής των μορίων στον πραγματικό κόσμο. Ένας από τους τρόπους με τους οποίους τα πραγματικά μόρια και οι δομές Lewis διαφέρουν είναι ότι τα άτομα είναι ικανά να σχηματίζουν ασταθή μόρια. Εν τω μεταξύ, όταν δημιουργούνται οι δομές Lewis, η υπόθεση είναι ότι τα άτομα θα έχουν γεμίσει, ή επιδιώκουν να γεμίσουν, τα κελύφη σθένους τους. Ο αριθμός των ηλεκτρονίων στο κέλυφος σθένους ενός ατόμου είναι πιο πιθανό να υπερβαίνει τα οκτώ όταν ο ατομικός αριθμός ενός στοιχείου είναι μεγαλύτερος.
Τα στοιχεία με υψηλότερο ατομικό αριθμό είναι πιο πιθανό να έχουν αριθμούς ηλεκτρονίων σθένους που υπερβαίνουν το οκτώ, και λόγω αυτής της δομής Lewis συνήθως δεν αποτελούνται από μόρια μετάλλων μετάπτωσης, καθώς έχουν συχνά περισσότερα από οκτώ ηλεκτρόνια στο κέλυφος σθένους τους. Τα μέταλλα μετάπτωσης όπως οι λανθανίδες και οι ακτινίδες τυχαίνει να είναι παραδείγματα στοιχείων με περισσότερα από οκτώ ηλεκτρόνια σθένους. Για αυτούς τους λόγους, θα πρέπει να θυμόμαστε ότι αν και οι δομές Lewis μπορούν να είναι εξαιρετικά χρήσιμες για την κατανόηση του τρόπου σχηματισμού των μορίων, δεν αντιπροσωπεύουν τέλεια τον τρόπο με τον οποίο τα άτομα αλληλεπιδρούν για να σχηματίσουν μόρια στον πραγματικό κόσμο.
Προσδιορισμός του αριθμού των ηλεκτρονίων σθένους με τον περιοδικό πίνακα
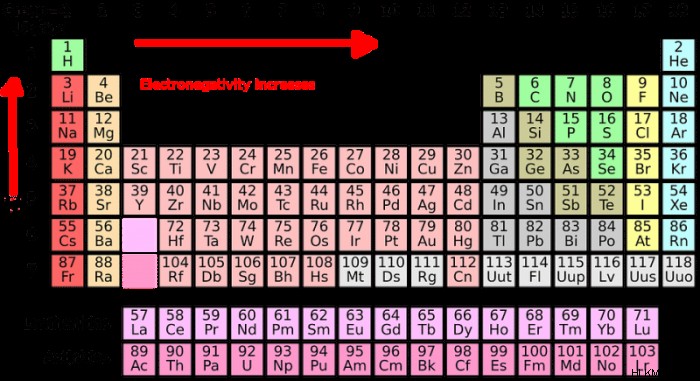
Όπως αναφέρθηκε παραπάνω, είναι δυνατό να προσδιοριστεί πόσα ηλεκτρόνια σθένους έχουν τα άτομα ενός συγκεκριμένου στοιχείου, συμβουλευόμενοι τον περιοδικό πίνακα των στοιχείων. Τα στοιχεία που βρίσκονται στον περιοδικό πίνακα είναι ταξινομημένα σε συγκεκριμένα μοτίβα, στήλες και σειρές. Οι ομάδες (στήλες) στον περιοδικό πίνακα οργανώνονται ανάλογα με το πόσο χημικά αντιδρούν, ή για να το θέσουμε διαφορετικά από το πόσα ηλεκτρόνια σθένους διαθέτουν τα άτομα του στοιχείου.
Ομάδες/στήλες στον περιοδικό πίνακα των στοιχείων έχουν όλες τον ίδιο αριθμό ηλεκτρονίων στη στιβάδα σθένους τους. Αυτό μπορεί να επιβεβαιωθεί ελέγχοντας τον αριθμό των ηλεκτρονίων σθένους στην πρώτη ομάδα του περιοδικού πίνακα. Η πρώτη ομάδα του περιοδικού πίνακα περιέχει στοιχεία όπως νάτριο, κάλιο, υδρογόνο και καίσιο. Κάθε ομάδα στοιχείων ενός του περιοδικού πίνακα έχει ακριβώς ένα ηλεκτρόνιο στο κέλυφος σθένους. Εν τω μεταξύ, στοιχεία που βρίσκονται στην ομάδα δύο έχουν δύο ηλεκτρόνια σθένους, συμπεριλαμβανομένων στοιχείων όπως το μαγνήσιο και το βηρύλλιο.
Αυτή η τάση αναφέρεται ως τάση ηλεκτραρνητικότητας και συνεχίζεται σε όλο τον περιοδικό πίνακα, με εξαίρεση τα μέταλλα μετάπτωσης στη μέση του πίνακα. Αυτά τα μέταλλα παραλείπονται όταν ομαδοποιούνται τα ηλεκτρόνια με αριθμούς ηλεκτρονίων σθένους. Εκτός αυτής της εξαίρεσης, η τάση στον περιοδικό πίνακα ισχύει και μπορεί να χρησιμοποιηθεί για τον προσδιορισμό του αριθμού των ηλεκτρονίων σθένους που διαθέτει ένα στοιχείο. Τα στοιχεία της ομάδας 8 του περιοδικού πίνακα έχουν ήδη ηλεκτρόνια στο κέλυφος σθένους και αναφέρονται ως ευγενή αέρια.