The Secret Power of the Cell’s Waste Bin
Σε ένα συνέδριο στο Μέιν το καλοκαίρι του 2008, ο βιοχημικός Ντέιβιντ Σαμπατίνι στάθηκε μπροστά σε ένα κοινό των συνομηλίκων του, προετοιμασμένος να τους θαμπώσει με μια προεπισκόπηση αδημοσίευτων αποτελεσμάτων που προέκυψαν από το εργαστήριό του στο Ινστιτούτο Βιοϊατρικής Έρευνας Whitehead στο Κέιμπριτζ της Μασαχουσέτης. Η παρουσίαση δεν πήγε καλά. Η ομάδα του μελετούσε το mTOR, ένα κυτταρικό ένζυμο που είχε ανακαλύψει ο ίδιος και οι συνεργάτες του περισσότερο από μια δεκαετία νωρίτερα. Μεταξύ άλλων, προσπάθησαν να ανακαλύψουν πού συσσωματώνεται το mTOR μέσα στα κύτταρα, καθώς αυτό φαινόταν πιθανό να εξηγεί την αξιοσημείωτη αλλά μυστηριώδη επιρροή του ενζύμου σε διάφορες διαδικασίες κυτταρικής ανάπτυξης. Ο Sabatini πρόβαλε με περηφάνια μια διαφάνεια με τα ευρήματα της ομάδας, δείχνοντας το ένζυμο διατεταγμένο κατά μήκος της επιφάνειας των οργανιδίων που ονομάζονται λυσοσώματα.
Το κοινό ήταν αμφίβολο. «Οι άνθρωποι κυριολεκτικά σηκώθηκαν και είπαν, «Ντέιβιντ, αυτός είναι ο κάδος απορριμμάτων του κελιού. Δεν έχει νόημα. Γιατί να διακοσμήσετε το εξωτερικό ενός κάδου σκουπιδιών;» Ο Sabatini υπενθύμισε.
Κατά τη διάρκεια των εννέα ετών από την ομιλία του Sabatini, τα λυσοσώματα έχουν κερδίσει περισσότερο σεβασμό. Η έρευνα συνεχίζει να δείχνει ότι τα λυσοσώματα υπερβαίνουν τον ρόλο του κάδου απορριμμάτων, λειτουργώντας ως κρίσιμοι σύμβουλοι του πυρήνα στη δουλειά του για τη γενετική ρύθμιση. Αυτό το άλμα σε επίπεδο ήταν προφανές στο τέταρτο Ερευνητικό Συνέδριο Gordon για τις Λυσοσωμικές ασθένειες, που πραγματοποιήθηκε στις 5-10 Μαρτίου στην Μπάργκα της Ιταλίας. Το λυσόσωμα γιορτάστηκε επίσης σε μια δημοσίευση που εμφανίστηκε τον περασμένο Οκτώβριο στο Annual Reviews of Cell and Developmental Biology , «Το Λυσόσωμα ως Ρυθμιστικό Κόμβο». Οι συγγραφείς του, οι ερευνητές του San Francisco Bay Area Rushika Perera και Roberto Zoncu, παρατήρησαν ότι πρόσφατες μελέτες «ανέβασαν την κατάσταση του λυσοσώματος από ένα καταβολικό αδιέξοδο σε έναν βασικό κόμβο σηματοδότησης, με εκτεταμένες επιπτώσεις στην κατανόηση της λογικής του μεταβολική ρύθμιση τόσο στην υγεία όσο και στην ασθένεια.»
Σε αυτόν τον υψηλότερο υπολογισμό των λυσοσωμάτων, τα οργανίδια ενσωματώνουν επιδέξια μεταβολικές πληροφορίες από όλο το κύτταρο και τις επικοινωνούν στον πυρήνα. Όπως οι συλλέκτες σκουπιδιών που κατασκοπεύουν που μαθαίνουν τα μυστικά όλων των ιδιοκτητών σπιτιού στη διαδρομή τους, τα λυσοσώματα αποκτούν μια μοναδικά ενημερωμένη προοπτική για την κατάσταση ενός κυττάρου διαλέγοντας τις μοριακές του απορρίψεις. Και ορισμένοι από τους λεπτομερώς συντονισμένους γενετικούς ελέγχους του πυρήνα θα ήταν πιθανώς χωρίς πιλότους χωρίς αυτούς.
Τα λυσοσώματα τράβηξαν την προσοχή για πρώτη φορά τη δεκαετία του 1950, όταν ο Βέλγος βιοχημικός Christian de Duve σκόνταψε πάνω στις σακουλιές ενδοκυτταρικές δομές ενώ προσπαθούσε να καθαρίσει μια πρωτεΐνη που βρέθηκε στα συκώτια αρουραίου. Ονόμασε τους προηγουμένως άγνωστους σάκους από το ελληνικό για το «πεπτικό σώμα», επειδή το περιεχόμενό τους ήταν πολύ όξινο και γεμάτο με ένζυμα που διασπούν ουσιαστικά κάθε βιομόριο που βρίσκεται μπροστά τους. Ο De Duve έλαβε το βραβείο Νόμπελ για την ανακάλυψή του το 1974, αλλά οι βιολόγοι δεν ήταν ενθουσιασμένοι με το οργανίδιο. Οι ερευνητές ονόμασαν το λυσόσωμα «ο κάδος ανακύκλωσης του κυττάρου ή ο κάδος σκουπιδιών — τίποτα ενδιαφέρον», είπε ο Zoncu, βιοχημικός στο Πανεπιστήμιο της Καλιφόρνια στο Μπέρκλεϋ.
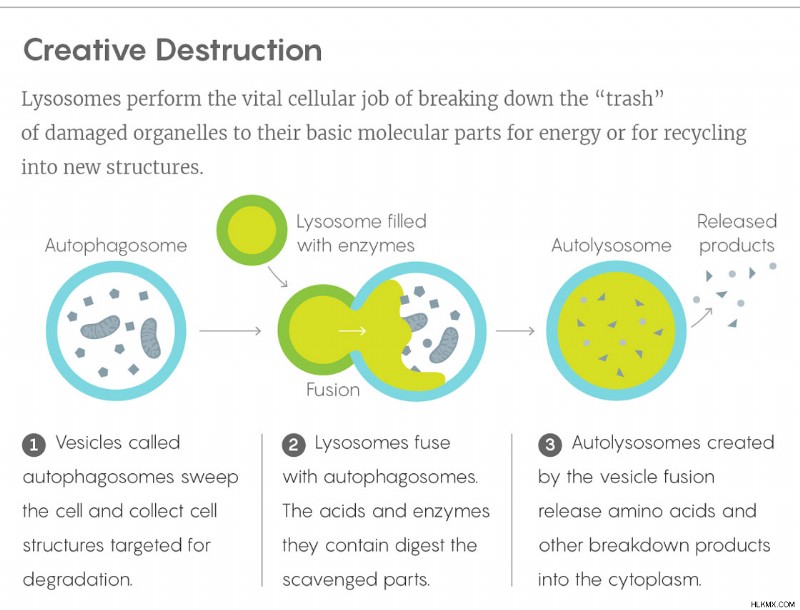
Δεν ήταν ότι τα λυσοσώματα δεν φαινόταν σημαντικά - τα συστήματα διάθεσης απορριμμάτων είναι αναπόφευκτα. Είναι υπεύθυνοι για την πέψη των κατεστραμμένων, κακοσχηματισμένων, περιττών ή αλλιώς ανεπιθύμητων πρωτεϊνών και οργανιδίων ενός κυττάρου, μαζί με τα υπερβολικά σάκχαρα και λίπη. Όταν τα γενετικά ελαττώματα κάνουν τα λυσοσώματα να παράγουν πολύ λίγα από τα 60 ή περισσότερα ένζυμα που σχετίζονται με αυτά, τα απόβλητα συσσωρεύονται μέσα στα κύτταρα και προκαλούν ασθένειες λυσοσωμικής αποθήκευσης, όπως Tay-Sachs, Niemann-Pick και άλλες διαταραχές. Επιπλέον, όπως αποδείχθηκε στη δεκαετία του 1990 μια σειρά πειραμάτων με επικεφαλής τον Yoshinori Ohsumi (πρώτα στο Πανεπιστήμιο του Τόκιο και μετά στο Εθνικό Ινστιτούτο Βασικής Βιολογίας της Ιαπωνίας), τα λυσοσώματα είναι επίσης καθοριστικά στη ζωτική διαδικασία της αυτοφαγίας, η οποία επιτρέπει στα κύτταρα να κανιβαλίζουν δικά τους οργανίδια για πόρους σε περιόδους ανάγκης και για την καταπολέμηση των επιπτώσεων της ασθένειας και της γήρανσης. Αυτό το έργο έφερε στον Ohsumi ένα βραβείο Νόμπελ το 2016 — ένα δεύτερο Νόμπελ που θα απονεμηθεί για το έργο που αφορούσε τον ταπεινό κάδο απορριμμάτων του κυττάρου.
Αλλά στη δεκαετία του 1980, όταν ο Andrea Ballabio, ο ιδρυτής του Telethon Institute of Genetics and Medicine στη Νάπολη, ξεκινούσε τη βιολογική έρευνα, οι μελέτες του λυσοσώματος επικεντρώθηκαν σχεδόν αποκλειστικά σε αυτό που συμβαίνει μέσα του. Υπενθυμίζει ότι το πεδίο αυτό οφείλεται σε βαριά και στενά ασθένειες:Οι ερευνητές λυσοσωμάτων καθάρισαν ένζυμα που ήταν ανεπαρκή ή δυσλειτουργικά σε συγκεκριμένες διαταραχές λυσοσωμικής αποθήκευσης.

Ο Ballabio είχε αρχίσει να ενδιαφέρεται για το λυσόσωμα ενώ μελετούσε ένα συγκεκριμένο είδος ασθένειας λυσοσωμικής αποθήκευσης. Η ανεπάρκεια πολλαπλής σουλφατάσης προκαλεί φολιδωτό δέρμα, δύσκαμπτες αρθρώσεις, επιληπτικές κρίσεις και αναπτυξιακές καθυστερήσεις. Τα συμπτώματα προκύπτουν από μεταλλάξεις σε ένα γονίδιο που, όπως ανακάλυψε η ομάδα του Ballabio, είναι απαραίτητο για την ενεργοποίηση μιας ομάδας ενζύμων που ονομάζονται σουλφατάσες, πολλά από τα οποία είναι λυσοσωμικά.
Αυτή η ανακάλυψη από την ομάδα του Ballabio, μαζί με άλλες μελέτες σπάνιων λυσοσωμικών διαταραχών, έπεισαν τον Ballabio ότι τα κύτταρα πρέπει να έχουν ένα σύστημα για την ενίσχυση της λυσοσωμικής δραστηριότητας και έναν τρόπο να αρχίσουν να παράγουν περισσότερα λυσοσώματα καθώς συσσωρεύονται κυτταρικά σκουπίδια. Για να γίνει αυτό, «πρέπει να ελέγχετε τη λειτουργία πολλών διαφορετικών γονιδίων», είπε ο Ballabio. Ξεκίνησε να βρει τους κύριους ρυθμιστές που το κάνουν αυτό.
Το 2009, η ομάδα του ανέφερε ότι είχε βρει ένα σημαντικό. Το ονόμασαν «παράγοντας μεταγραφής EB» ή TFEB. Στον πυρήνα του κυττάρου, το TFEB συνδέεται με αλληλουχίες DNA σε πολλά λυσοσωμικά γονίδια και ελέγχει τον ρυθμό με τον οποίο παράγουν πρωτεΐνες.
Ωστόσο, το πώς ακριβώς η δραστηριότητα του TFEB θα μπορούσε να αντικατοπτρίζει τις ανάγκες του κυττάρου για λυσοσώματα τόσο ολοκληρωμένα, ήταν ακόμα άγνωστο. Αλλά σύντομα θα προέκυπτε μια απάντηση από την εργασία που, τουλάχιστον αρχικά, δεν είχε καμία σχέση με τα λυσοσώματα.
A Seat of signaling
Όταν ο Roberto Zoncu έφτασε ως μεταδιδάκτορας στο εργαστήριο του Sabatini στο Ινστιτούτο Whitehead το 2008, τα λυσοσώματα δεν ήταν στο μυαλό του. Η εστίαση του εργαστηρίου ήταν (και με πολλούς τρόπους εξακολουθεί να είναι) στο ένζυμο που είχε ανακαλύψει ο Sabatini σε κύτταρα θηλαστικών το 1994 και ονομάστηκε μηχανιστικός στόχος της ραπαμυκίνης (mTOR). Εμπλεκόμενος στη γήρανση και σε μια σειρά ασθενειών, συμπεριλαμβανομένου του καρκίνου και του διαβήτη, το mTOR σηματοδοτεί τα κύτταρα να αναπτυχθούν και να διαιρεθούν κάτω από μια εκπληκτικά μεγάλη ποικιλία περιστάσεων. «Ένα από τα μεγάλα ερωτήματα που μας δίνουν κίνητρο ήταν:Πώς συμβαίνει αυτό;» είπε ο Σαμπατίνι. "Πώς καταφέρνει η mTOR να αισθάνεται τόσα πολλά πράγματα, να ενσωματώνει αυτά τα σήματα και να οδηγεί την ανάπτυξη;"
Μια κρίσιμη ένδειξη ήρθε όταν η ομάδα παρακολούθησε τις κινήσεις της πρωτεΐνης μέσα στα κύτταρα. Όταν τα κύτταρα λούστηκαν σε μέσα χωρίς αμινοξέα, το mTOR φαινόταν να εξαπλώνεται ομοιόμορφα σε όλο το κυτταρόπλασμα. Αλλά εάν τα μέσα περιείχαν αμινοξέα, μέσα σε λίγα λεπτά το mTOR μετακινήθηκε σε διακριτές ομάδες σε συγκεκριμένες τοποθεσίες μέσα στο κύτταρο, που φυλάσσονταν εκεί από άλλες πρωτεΐνες που ονομάζονται Rag GTPases. Η ενζυματική δραστηριότητα του mTOR εξαρτιόταν από το να φτάσει σε αυτές τις τοποθεσίες, αλλά οι πρωτεΐνες που το οδήγησαν εκεί δεν φάνηκε να το ενεργοποιούν. «Ήμασταν κολλημένοι», είπε ο Sabatini.
Ο Zoncu λοιπόν ξεκίνησε να μάθει τι ήταν το ιδιαίτερο σχετικά με το πού πήγαινε η πρωτεΐνη mTOR ως απόκριση στα αμινοξέα. Σε ένα βασικό πείραμα, έβαψε τα κύτταρα με ζεύγη φθοριζόντων αντισωμάτων:ένα κόκκινο που δέσμευε το mTOR και ένα πράσινο που σχεδιάστηκε για να συνδέεται με μια πρωτεΐνη που σχετίζεται με ένα διαφορετικό οργανίδιο σε κάθε γύρο του πειράματος. Στη συνέχεια εξέτασε τα κύτταρα κάτω από το μικροσκόπιο, αναζητώντας πού αλληλεπικαλύπτονταν οι πράσινες και κόκκινες φθορίζουσες ετικέτες. Αυτό θα υποδείκνυε τι άλλο βρισκόταν στα σημεία όπου συγκεντρώθηκε το mTOR.
Σάρωση της διαφάνειας που κηλιδώθηκε για μιτοχόνδρια - ένας πιθανός στόχος τεράστιας μεταβολικής σημασίας - ο Zoncu δεν βρήκε επικάλυψη. Προχώρησε στη διαφάνεια για το επόμενο οργανίδιο και το επόμενο. Ακόμα δεν υπάρχει επικάλυψη. «Σχεδόν έχασα την ελπίδα μου», θυμάται ο Zoncu.
Μετά ήρθε η διαφάνεια του λυσοσώματος. «Ξαφνικά, όλα ταίριαξαν τέλεια», είπε. Η κόκκινη χρώση mTOR και η πράσινη χρώση για τον λυσοσωμικό δείκτη LAMP2 επικαλύπτονταν 100 τοις εκατό.
Αύξηση του ανακυκλωτή
Αυτά τα αποτελέσματα πρόσθεσαν περαιτέρω υποστήριξη στα δεδομένα που ανέφερε ο Sabatini στο συνέδριο του Maine το 2008 στο απαρηγόρητο κοινό του. Αλλά ακόμη και ο Zoncu αναγνωρίζει ότι ο σκεπτικισμός μπορεί να ήταν δικαιολογημένος. Τα λυσοσώματα, λέει, θα μπορούσαν ακόμα «να ήταν απλώς ένα σημείο προσγείωσης» - ένα βολικό μέρος για να αγγίξει το mTOR κατά την ενεργοποίηση.
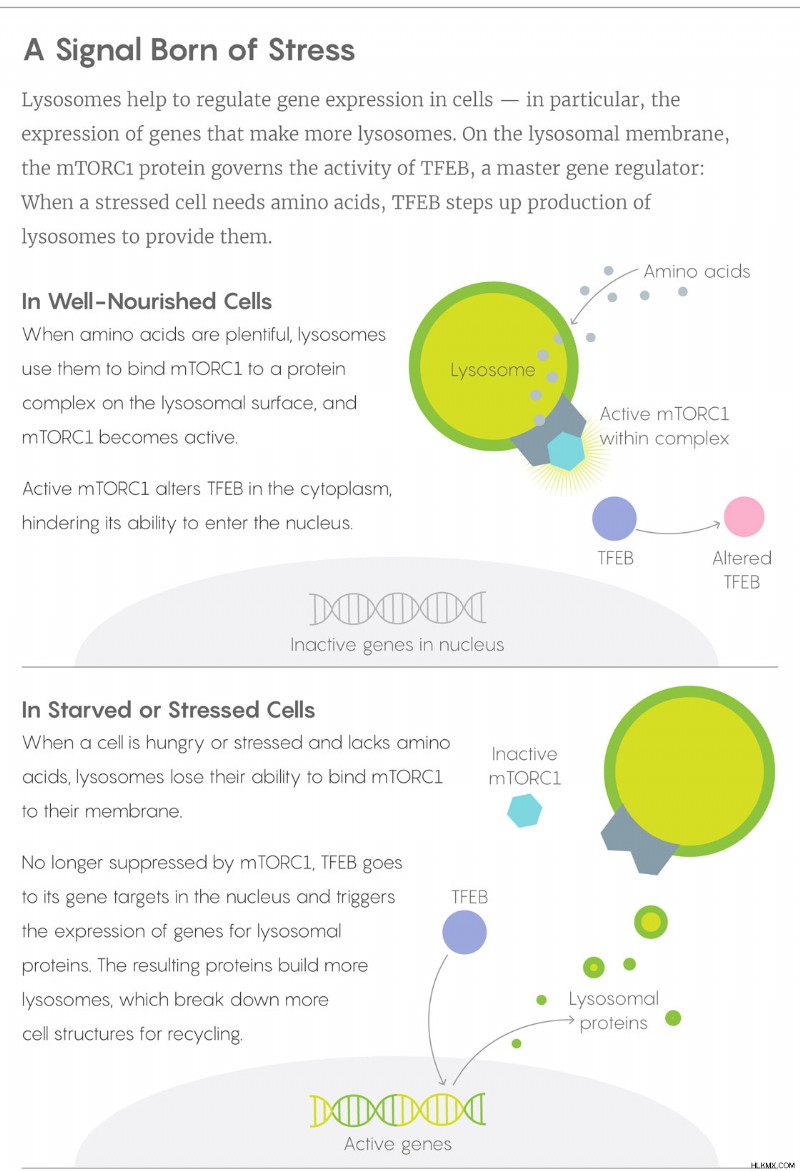
Ωστόσο, μεταγενέστερα πειράματα πρότειναν το αντίθετο. Όταν ο Zoncu εξήγαγε λυσοσώματα από τα κύτταρα και τα φόρτωσε με αμινοξέα, είδε ότι όσο περισσότερα αμινοξέα μετέφεραν, τόσο περισσότερα mTOR συγκεντρώνονταν στην επιφάνειά τους και γινόταν ενεργό. (Το ένζυμο mTOR σχηματίζει δύο πρωτεϊνικά σύμπλοκα στο κύτταρο· το σύμπλοκο mTOR 1 [mTORC1] είναι αυτό που βρίσκεται στα λυσοσώματα.) Αυτά τα πειράματα, που δημοσιεύθηκαν το 2011, δείχνουν ότι το mTORC1 ανταποκρίνεται στα λυσοσωμικά περιεχόμενα, λέει ο Sabatini - σαν να λένε τα λυσοσώματα Το mTORC1 σχετικά με τα αμινοξέα που συγκρατούν και το mTORC1 προσαρμόζει ανάλογα τη συμπεριφορά του.
Διεύρυνση της κινητής συνομιλίας
Όταν το εργαστήριο του Ballabio και ο Sabatini έμαθαν ο ένας για τα αποτελέσματα του άλλου και ένωσαν τις δυνάμεις τους, σύντομα ανακάλυψαν πώς τα κομμάτια mTORC1 και TFEB του παζλ ταιριάζουν μεταξύ τους, δημοσιεύοντας τη λύση το 2012. Σε ένα υγιές, καλά τροφοδοτημένο κύτταρο, τα λυσοσώματα έχουν κεράτινη επιφάνεια πρωτεΐνες για να διασπαστούν στα συστατικά αμινοξέων τους και αυτά τα αμινοξέα συνεργάζονται με πρωτεΐνες στην επιφάνεια του λυσοσώματος για να αγκιστρώσουν το mTORC1 και να το ενεργοποιήσουν. Το mTORC1 με τη σειρά του κρατά το κυτταροπλασματικό TFEB έξω από τον πυρήνα. Όταν ένα κύτταρο λιμοκτονεί ή στρεσάρεται, το mTORC1 πέφτει μακριά από το λυσόσωμα και το TFEB ελευθερώνεται για να δεσμεύσει τους στόχους του στο πυρηνικό DNA. Λειτουργώντας ως κύριος αισθητήρας της λυσοσωμικής λειτουργίας, το TFEB ενεργοποιεί γονίδια για περισσότερα λυσοσωμικά ένζυμα.
Η ασιτία δεν είναι ο μόνος στρεσογόνος παράγοντας που απελευθερώνει το TFEB από τα λυσοσώματα. Ο Ballabio και οι συνεργάτες του έδειξαν πρόσφατα ότι το TFEB μπορεί να συνδεθεί με φερμουάρ στον πυρήνα για να βοηθήσει τα κύτταρα να χειριστούν άλλα στρεσογόνα σενάρια. Σύμφωνα με τον Ballabio, αρκετές ομάδες έχουν δείξει ότι η χορήγηση TFEB ως γονιδιακής θεραπείας σε ποντίκια μπορεί να βοηθήσει στην ανακούφιση των συμπτωμάτων ασθενειών λυσοσωμικής αποθήκευσης, παχυσαρκίας και διαβήτη που προκαλείται από τη διατροφή και νευροεκφυλιστικών καταστάσεων παρόμοιες με τη νόσο του Αλτσχάιμερ και τη νόσο του Πάρκινσον.
Στις αρχές Μαρτίου, ενώ προήδρευε στη διάσκεψη Gordon για τα λυσοσώματα, ο Ballabio συλλογίστηκε τηλεφωνικά στο Quanta για το πόσο δραματικά είχε αλλάξει το πεδίο. Το πεδίο κάποτε αφορούσε συντριπτικά τις ασθένειες αποθήκευσης λυσοσωμάτων. Τώρα, λέει, οι ερευνητές ασθενειών συναναστρέφονται ελεύθερα με εκείνους που κάνουν βασική έρευνα. Και η εστίαση στις ανεπάρκειες μέσα στα λυσοσώματα είχε μετατοπιστεί στη λυσοσωμική μεμβράνη και στους τρόπους με τους οποίους στρατολογεί τα TFEB, mTOR και περίπου 200 άλλες ταυτοποιημένες πρωτεΐνες σε μια συνομιλία με το υπόλοιπο κύτταρο.
Ο καρκίνος είναι μια επίμονη πάθηση που μπορεί να οδηγήσει στην καλύτερη κατανόηση των λυσοσωμάτων. Επειδή τα καρκινικά κύτταρα χρειάζονται άφθονα θρεπτικά συστατικά για να αναπτυχθούν, «πρέπει να επαναπρογραμματίσουν ή να καλωδιώσουν ξανά το στομάχι τους - τα λυσοσώματά τους - για να λάβουν και να επεξεργαστούν πολλά τρόφιμα», δήλωσε ο Perera, βιολόγος καρκίνου στο Πανεπιστήμιο της Καλιφόρνια στο Σαν Φρανσίσκο. /P>
Αυτή και ο Zoncu διερευνούν από κοινού τις διαφορές μεταξύ των λυσοσωμάτων κακοήθων και φυσιολογικών κυττάρων. Επιπλέον, εργάζονται για τον εντοπισμό επιφανειακών πρωτεϊνών στο λυσόσωμα που αφήνουν τα θρεπτικά συστατικά να διαφύγουν στο κυτταρόπλασμα για να χρησιμοποιηθούν τα καρκινικά κύτταρα. Τέτοιες πρωτεΐνες θα μπορούσαν να αξιοποιηθούν ως πύλες για την εισαγωγή τοξινών ή φαρμάκων που θα συλλέγουν τα καρκινικά κύτταρα στα λυσοσώματά τους, εις βάρος τους.
Μια άλλη ενδιαφέρουσα πιθανότητα προέρχεται από τον Ralph A. Nixon, έναν νευροεπιστήμονα στο Ιατρικό Κέντρο Langone του Πανεπιστημίου της Νέας Υόρκης, ο οποίος επίσης μίλησε στο συνέδριο του λυσοσώματος. Πειράματα στο εργαστήριό του και άλλων έχουν συνδέσει την αποτυχία των λυσοσωμάτων με την κυτταρική γήρανση, τη μειωμένη μακροζωία και μια σειρά από νευροεκφυλιστικές διαταραχές. Το 2015 ο Nixon και οι συνεργάτες του έδειξαν ότι ορισμένες γονιδιακές μεταλλάξεις που συνδέονται με τη νόσο του Alzheimer απενεργοποιούν μια αντλία πρωτονίων που διατηρεί το pH των λυσοσωμάτων. Αυτή η αλλαγή στην οξύτητα, η οποία μεταβάλλει την ισορροπία των ιόντων και των μεταβολιτών που μεταναστεύουν από τα λυσοσώματα, μπορεί να βλάψει το μεταβολισμό ενός κυττάρου.
Οι νευρώνες μπορεί να είναι μοναδικά ευάλωτοι σε αυτό το είδος λυσοσωμικής διαταραχής χαμηλού επιπέδου, λέει ο Nixon, και αυτό θα μπορούσε να εξηγήσει γιατί οι λυσοσωμικές διαταραχές έχουν τόσο συχνά νευρολογικές συνέπειες. Εάν μελλοντικές φαρμακευτικές παρεμβάσεις θα μπορούσαν να διορθώσουν προβλήματα με τη λυσοσωμική αντλία πρωτονίων ή με άλλες διαταραχές της λειτουργίας των λυσοσωμάτων, μπορεί να είναι δυνατό να αποτραπούν ορισμένες από τις νευροεκφυλιστικές επιδράσεις της νόσου του Αλτσχάιμερ ή άλλων καταστάσεων. Αρκετές φαρμακευτικές ενώσεις που τροποποιούν τη λυσοσωμική λειτουργία - είτε αυξάνοντας τα ποσοστά αυτοφαγίας είτε αυξάνοντας τους ρυθμούς δημιουργίας λυσοσωμάτων ή και τα δύο - έχουν δείξει πολλά υποσχόμενα ενάντια στις νευρολογικές παθήσεις στα ποντίκια, λέει ο Nixon.
Τα λυσοσώματα μπορεί κάποτε να φαίνονταν σαν κάδοι σκουπιδιών που ήταν «βαρετοί εξωτερικά», λέει ο Nixon, αλλά εκτιμώνται όλο και περισσότερο ως ρυθμιζόμενες πλατφόρμες σημάτων ζωτικής σημασίας για την κυτταρική υγεία. Και καθώς οι προοπτικές για το λυσόσωμα αλλάζουν, αλλάζουν και οι απόψεις της σχετικής βιολογίας. Ο Perera σημειώνει ότι οι ερευνητές του καρκίνου ήθελαν από καιρό να μάθουν περισσότερα για τα σήματα που αφήνουν τα κακοήθη κύτταρα να αναπτύσσονται και να πολλαπλασιάζονται ασταμάτητα, και για το πώς τα κύτταρα συνεπιλέγουν θρεπτικά συστατικά. Η νέα άποψη για τα λυσοσώματα, λέει, αποκαλύπτει ότι «όλα αυτά είναι διαφορετικές πτυχές του ίδιου προβλήματος».