Υπολογισμός Μοριακότητας Παράδειγμα Πρόβλημα 1

Η μοριακότητα είναι ένα μέτρο της συγκέντρωσης μιας διαλυμένης ουσίας σε ένα διάλυμα. Αυτό το παράδειγμα μοριακού προβλήματος δείχνει τα βήματα που απαιτούνται για τον υπολογισμό της μοριακότητας ενός διαλύματος δεδομένης της ποσότητας της διαλυμένης ουσίας και του επιθυμητού όγκου διαλύματος.
Πρόβλημα
Υπολογίστε τη μοριακότητα ενός διαλύματος που δημιουργήθηκε ρίχνοντας 7,62 γραμμάρια MgCl2 σε αρκετό νερό ώστε να δημιουργηθούν 400 mL διαλύματος.
Λύση
Ο τύπος για τον υπολογισμό της μοριακότητας είναι

Σε αυτή την περίπτωση, η διαλυμένη ουσία είναι 7,62 γραμμάρια MgCl2 . Ο τύπος χρειάζεται τον αριθμό των κρεατοελιών.
Χρησιμοποιώντας έναν περιοδικό πίνακα, η μοριακή μάζα του MgCl2 είναι 95,21 γραμμάρια/mol. Βρείτε τον αριθμό των mole σε 7,62 γραμμάρια σε MgCl2 .
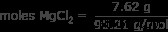
moles MgCl2 =0,08 moles
Η μοριακότητα πρέπει επίσης να έχει τον όγκο σε λίτρα, όχι χιλιοστόλιτρα.
Ο τελικός όγκος του διαλύματός μας είναι 400 mL, δηλαδή 0,4 L.
Συνδέστε αυτές τις πληροφορίες στον τύπο

M =0,2 moles/L ή 0,2 M
Απάντηση
Η συγκέντρωση MgCl2 στο διάλυμα είναι 0,2 M.